Хром-металл является одним из наиболее распространенных и важных элементов в периодической таблице химических элементов. Его важность обусловлена не только его широким использованием в промышленности, но и его уникальными химическими свойствами. Электронная конфигурация хром-металла имеет особенности, которые играют важную роль в его химической активности и реакционной способности.
Электронная конфигурация хром-металла представляет собой распределение его электронов по энергетическим уровням и подуровням. Особенностью хром-металла является его половинное заполнение d-подуровней, что отличает его от других металлов. Такая структура электронной оболочки придает хрому его уникальные физические и химические свойства, в том числе его высокую термостабильность, магнитные и каталитические свойства.
Важность электронной конфигурации хром-металла проявляется в его способности образовывать оксиды и соединения с различными элементами. Благодаря своей электронной структуре, хром-металл обладает способностью образовывать сложные соединения, которые широко используются в промышленности. Например, хром-металл является необходимым компонентом в производстве нержавеющих сталей, которые обладают высокой коррозионной стойкостью и прочностью.
Изучение электронной конфигурации хром-металла позволяет получить глубокое понимание его химических свойств и использовать их в различных областях, включая технологии, энергетику и медицину.
В заключение, электронная конфигурация хром-металла является важным аспектом его химической активности и особенностей. Она определяет его уникальные физические и химические свойства, а также его способность образовывать сложные соединения. Изучение электронной конфигурации хром-металла имеет большое значение для практического применения этого важного элемента в науке, технологиях и промышленности.
Электронная конфигурация хром-металла: особенности и значение
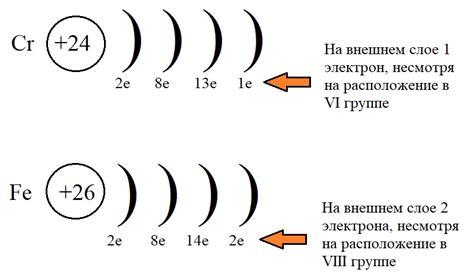
Хром (Cr) - это тяжелый металл, который относится к переходным элементам в периодической таблице. Его атомный номер равен 24, а атомная масса примерно равна 52. Вместе с железом и никелем, хром является одним из основных компонентов стали, что делает его важным металлом в промышленности.
Электронная конфигурация хром-металла можно записать как [Ar] 3d5 4s1. Существует интересная особенность в его конфигурации: вместо того чтобы иметь полностью заполненную оболочку 4s, хром предпочитает иметь одиночный электрон в этой оболочке. Это явление называется "эффектом выталкивания" и объясняется более стабильной конфигурацией с одиночным 4s электроном.
Значение электронной конфигурации хром-металла заключается в его химических и физических свойствах. Уникальная электронная конфигурация хрома позволяет ему образовывать различные валентные состояния, что делает его полезным при создании специальных сплавов и катализаторов. Также, эта особенность делает хром-металл прочным и устойчивым к коррозии, что делает его идеальным для использования в автомобильной и строительной промышленности.
В завершение, хром-металл имеет важное значение в различных областях, включая производство стали, химическую промышленность и оборону. Его уникальная электронная конфигурация способствует его физическим и химическим свойствам, делая его неотъемлемым компонентом современной промышленности.
Определение и общая характеристика

Электронная конфигурация хром-металла относится к расположению электронов в атоме хрома, который является переходным металлом. Хром представляет собой элемент с атомным номером 24 и химическим символом Cr в периодической системе элементов. Его электронная конфигурация определяет распределение электронов по энергетическим уровням и подуровням в атоме хрома.
Особенностью электронной конфигурации хром-металла является наличие полностью заполненного подуровня d5. Это означает, что у атома хрома в его последнем энергетическом уровне находятся пять электронов, заполняющих все пять спиновых орбиталей d-подуровня. Такая электронная конфигурация придает хрому уникальные свойства и влияет на его химическую активность и способность образовывать соединения.
Специфика электронной конфигурации хром-металла связана с его местом в периодической системе элементов. Элементы периода d имеют возможность образовывать соединения в различных валентностях, их химическое поведение определяется частично электронной конфигурацией d-подуровня. В случае хрома, наличие полностью заполненного подуровня d обусловливает его способность образовывать разнообразные соединения и придает этому металлу особый химический характер.
Роль электронной конфигурации в химических свойствах
Электронная конфигурация является ключевым понятием в химии, определяющим поведение атома или иона в химических реакциях. Она указывает на то, как электроны распределены в энергетических уровнях атома и определяет его структуру и химические свойства.
Количество электронов в атоме хрома обусловлено его полной электронной конфигурацией, которая включает двухэлектронную оболочку, шесть электронов в трехэлектронных подуровнях 3d и шесть электронов в 4s подуровне. Это распределение электронов определяет электронную структуру хрома и влияет на его химические свойства.
Электронная конфигурация хрома обуславливает его способность образовывать различные типы соединений. Наличие частично заполненных подуровней 3d и 4s делает хром металлом с переменным степенями окисления. Он может образовывать соединения со степенью окисления +2, +3 и +6, проявляя различную химическую активность в зависимости от условий.
Наличие нескольких электронов в подуровнях 3d также влияет на способность хрома к образованию комплексов. Он может образовывать стабильные комплексы с различными лигандами, такими как аммиак, хлориды, оксиды и другие. Это делает хром важным и широко используемым металлом в качестве катализатора, красителя и добавки в различных промышленных процессах.
Таким образом, электронная конфигурация хрома играет важную роль в определении его химических свойств. Это позволяет металлу проявлять разную химическую активность и образовывать разнообразные соединения и комплексы, что делает его полезным и востребованным в различных отраслях химической промышленности.
Особенности электронной конфигурации хрома
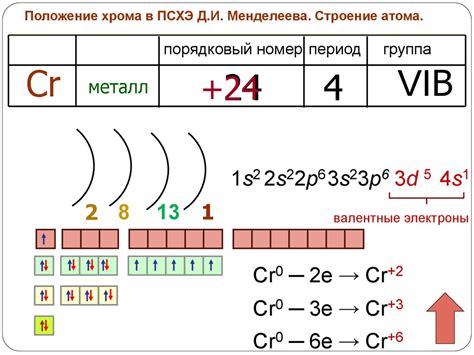
Хром (Cr) является химическим элементом с атомным номером 24 и принадлежит к переходным металлам. Его электронная конфигурация обладает рядом особенностей, которые определяют его уникальные химические и физические свойства.
В основной оболочке хрома находятся 4 электрона. Эти электроны заполняют уровни s и p, их конфигурация может быть представлена как [Ar] 3d^5 4s^1. Однако, в химических соединениях хром чаще принимает электронную конфигурацию [Ar] 3d^4 4s^2, так как такой вариант конфигурации обладает более стабильной энергией.
Примечательно, что у хрома существует несколько изотопов с разным количеством нейтронов. Изотопы хрома суммируются в общую электронную конфигурацию, что придает этому металлу еще больше разнообразия свойств. Например, изотоп хрома с 50 нейтронами имеет слабый магнитный момент, в то время как изотоп с 53 нейтронами обладает очень сильным магнитным моментом.
Электронная конфигурация хрома также влияет на его способность образовывать химические соединения. Часто хром проявляет свою особенную активность, образуя комплексные соединения с другими веществами. Например, красное соединение хрома - хромат калия (K2CrO4) - часто используется в аналитической химии для обнаружения присутствия ионов свинца или бария.
Значение электронной конфигурации хром-металла в промышленности

Хром-металл, а именно его электронная конфигурация, имеет большое значение в промышленности. Этот металл имеет атомное число 24 и общую электронную конфигурацию [Ar] 3d54s1. Такая конфигурация позволяет хрому образовывать соединения с различными элементами, что делает его полезным материалом в производстве различных продуктов.
Одним из важных применений хром-металла является его использование в производстве нержавеющей стали. Это связано с тем, что электронная конфигурация хром-металла позволяет ему образовывать оксидную пленку на поверхности стали, которая защищает материал от коррозии. Такие стали широко применяются в различных сферах, включая строительство, автомобильную промышленность и пищевую промышленность.
Кроме того, хром-металл используется в производстве хромированных изделий. Благодаря своей электронной конфигурации, хром образует плотную и устойчивую пленку, которая придает изделиям особенный блеск и защищает их от воздействия окружающей среды. Это делает хромированные изделия популярными в автомобильной и электронной промышленности, а также в производстве бытовой техники и мебели.
Кроме того, хром-металл используется в производстве красителей и пигментов. Это связано с его способностью образовывать различные соединения с органическими соединениями. Хроматы, которые содержат хром, обеспечивают яркие и стабильные цвета, которые широко используются в текстильной и красочной промышленности.
В целом, электронная конфигурация хром-металла определяет его химические свойства и делает его ценным материалом в различных областях промышленности. Понимание этих свойств и применение хрома в производстве позволяют создавать инновационные продукты и материалы, которые удовлетворяют потребности современного общества.
Вопрос-ответ

Какова электронная конфигурация хром-металла?
Электронная конфигурация хром-металла представляет собой следующую последовательность: 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Внешний электрон хрома находится в 4s подслое, а остальные 5 электронов в 3d подслое.
Каково значение электронной конфигурации хром-металла?
Электронная конфигурация хром-металла имеет важное значение для его химических и физических свойств. Например, благодаря своей конфигурации, хром обладает высокой коррозионной стойкостью и является ключевым компонентом в производстве нержавеющей стали. Кроме того, электронная конфигурация влияет на валентность хрома и его способность образовывать соединения с другими элементами.
Какие особенности можно отметить в электронной конфигурации хром-металла?
Одной из особенностей электронной конфигурации хрома является полная 3d подоболочка, несмотря на то, что подслои 4s и 3d могут быть заполнены разные порядками энергии. Кроме того, электронная конфигурация хрома также отличается от простого заполнения энергетических уровней, что приводит к его уникальным химическим свойствам.
