Хлор – это химический элемент с атомным номером 17 и обозначением Cl. Этот элемент принадлежит к галогенам и является одним из наиболее активных неинертных газов.
Хлор широко используется в различных процессах и реакциях, особенно в окислительно-восстановительных реакциях с металлами. Он обладает способностью вступать в реакцию с металлическими элементами и изменять их степень окисления.
В окислительно-восстановительных реакциях хлор может выступать в качестве окислителя, принимая электроны от металла, или в качестве восстановителя, отдавая электроны металлу. При этом происходит изменение степени окисления металла и хлора.
В результате реакций хлора с металлами обычно образуются хлориды металлов. Некоторые хлориды металлов обладают высокой стабильностью и находят широкое применение в различных отраслях промышленности и научных исследований.
Исследования в области окислительно-восстановительных реакций хлора с металлами имеют большое значение для разработки новых материалов с улучшенными свойствами и создания эффективных методов обработки и очистки различных веществ.
Окислительно-восстановительные реакции
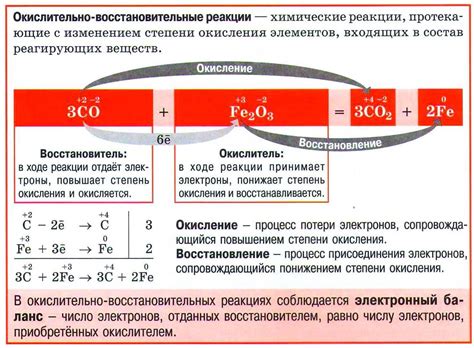
Окислительно-восстановительные реакции, также известные как реакции окисления и восстановления, являются важным классом химических реакций, которые происходят между веществами в результате передачи электронов. В таких реакциях одно вещество теряет электроны (окисляется), а другое вещество получает электроны (восстанавливается). Важно отметить, что окисление и восстановление происходят одновременно в окислительно-восстановительных реакциях.
Хлор, как сильный окислитель, часто выполняет роль окислителя в таких реакциях. Он способен принимать электроны от других веществ, что приводит к его снижению. Например, хлор может окислить железо, тем самым сам восстанавливаясь. Окислительные свойства хлора делают его эффективным веществом для удаления органических загрязнений из воды и других сред.
Окислительно-восстановительные реакции с участием металлов также являются важными. Некоторые металлы могут быть окислителями, передавая свои электроны другим веществам. Примером такой реакции является окисление цинка медью. В результате этой реакции цинк окисляется до иона цинка, теряя два электрона, а медь восстанавливается до нейтральных атомов, получая два электрона.
Окислительно-восстановительные реакции широко используются в промышленности и в повседневной жизни. Они могут быть использованы для очистки воды, генерации электричества в батареях, покрытия металлов защитным слоем и многих других применений. Понимание этих реакций позволяет контролировать процессы окисления и восстановления и использовать их в различных технологиях и химических процессах.
Роль хлора в окислительно-восстановительных реакциях

Хлор является мощным окислителем и активно участвует в окислительно-восстановительных реакциях (ОВР). В таких реакциях хлор способен принимать электроны от другого вещества, одновременно сам восстанавливаясь. Это делает его эффективным веществом для окисления металлов.
При взаимодействии хлора с металлами происходит окисление металла, при котором он отдает электроны, а хлор сам восстанавливается, получая от металла электроны. Оксид металла и хлорид металла образуются в результате таких реакций.
Окислительное действие хлора особенно проявляется в присутствии воды или кислот. При этом хлор способен окислять металлы, даже если их окислительная способность не очень высокая. Например, хлор может окислить цинк по уравнению:
Zn + Cl2 → ZnCl2
Кроме того, хлор может окислять более реактивные металлы, такие как натрий или калий, образуя соответствующие хлориды металлов. Например:
2Na + Cl2 → 2NaCl
Хлор также может быть восстановлен металлами. Например, при нагревании хлорида металла с металлическим порошком происходит реакция восстановления, при которой хлор переходит в свободное состояние:
2Al + 3Cl2 → 2AlCl3
Таким образом, роль хлора в окислительно-восстановительных реакциях является значительной. Он может быть использован как окислитель или восстановитель при взаимодействии с различными металлами в разных условиях.
Взаимодействие хлора с металлами
Хлор (Cl) – химический элемент второго периода таблицы Менделеева, обладающий высокой активностью в химических реакциях. Взаимодействие хлора с металлами является одной из наиболее распространенных и важных окислительно-восстановительных реакций.
В большинстве случаев хлор обладает окислительными свойствами и способен выступать в качестве окислителя при контакте с металлами. Взаимодействие хлора с металлами может привести к образованию хлоридов металлов.
Некоторые металлы, такие как натрий (Na) и калий (K), реагируют с хлором при обычных условиях, без нагревания. В результате такой реакции образуются хлориды соответствующих металлов – натриевый хлорид (NaCl) и калиевый хлорид (KCl).
Однако не все металлы реагируют с хлором легко. Например, металлы алюминий (Al) и железо (Fe) покрываются оксидной пленкой, которая предотвращает прямое взаимодействие металла с хлором. Для проведения реакции необходимо нагревание или использование катализаторов.
Взаимодействие хлора с металлами играет важную роль в разных областях науки и промышленности, включая производство химических соединений, очистку воды, производство металлов и т.д. Изучение и понимание этих реакций позволяет оптимизировать процессы и получать желаемые продукты с высокой степенью чистоты и качества.
Вопрос-ответ

В чем заключается роль хлора в окислительно-восстановительных реакциях с металлами?
Хлор играет роль окислителя в окислительно-восстановительных реакциях с металлами. Он способен отдавать электроны, что позволяет окислять металлы и превращать их в ионы.
Какие металлы могут реагировать с хлором?
Хлор может реагировать с большим количеством металлов, включая щелочные металлы (например, натрий и калий), щелочноземельные металлы (например, магний и кальций), а также некоторые тяжелые металлы, такие как железо и медь.
