Хлор и иод – химические элементы, которые обладают различными свойствами и реакционной способностью при контакте с металлами. Хлор является галогеном и часто используется в промышленности, а иод – популярный элемент в фармацевтической и пищевой промышленности
Хлор обладает сильными окислительными свойствами и при контакте с металлами может вызвать реакцию окисления и выделение тепла. Реакция хлора с металлами может происходить с образованием хлоридов металлов, которые обладают различными свойствами и применяются в различных отраслях промышленности.
Иод, напротив, обладает меньшей реакционной способностью и при контакте с металлами может происходить слабое окисление. Реакция иода с металлами также может приводить к образованию иодидов металлов, которые используются в различных отраслях промышленности и науки.
Несмотря на различия в свойствах и реакционной способности хлора и иода с металлами, оба элемента являются важными в химической промышленности и находят широкое применение в различных отраслях.
Реакция хлора и иода с металлами
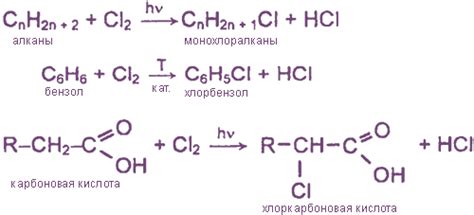
Хлор и иод - это два химических элемента, которые могут образовывать реакции с различными металлами. Реакция хлора с металлами в большинстве случаев протекает с образованием хлорида металла, в то время как реакция иода с металлами приводит к образованию иодида металла.
Хлор и иод являются хлоросодержащими и иодосодержащими кислотами, соответственно. Когда хлор или иод взаимодействуют с металлами, протон от кислоты - в данном случае хлора или иода - сначала переходит на электрон металла, а затем металл ионизируется. В результате образуется хлорид металла или иодид металла.
Реакция хлора или иода с металлами может быть представлена в виде химического уравнения:
- Хлор + Металл → Хлорид металла
- Иод + Металл → Иодид металла
Таблица ниже показывает некоторые примеры реакций хлора и иода с различными металлами:
| Металл | Хлор | Иод |
|---|---|---|
| Натрий (Na) | Na + Cl2 → NaCl | 2Na + I2 → 2NaI |
| Магний (Mg) | Mg + Cl2 → MgCl2 | — |
| Алюминий (Al) | 2Al + 3Cl2 → 2AlCl3 | — |
| Железо (Fe) | Fe + Cl2 → FeCl2 | 2Fe + 3I2 → 2FeI3 |
| Медь (Cu) | — | Cu + I2 → CuI2 |
Таким образом, реакция хлора и иода с металлами приводит к образованию их хлоридов и иодидов соответственно. Эти реакции являются основой для получения хлоридов и иодидов металлов и используются в различных областях, в том числе в химической промышленности и лабораториях.
Особенности взаимодействия хлора и иода с металлами

Хлор и иод - это два химически активных элемента, которые способны взаимодействовать с различными металлами. Взаимодействие хлора и иода с металлами имеет свои особенности и может проходить различными способами в зависимости от условий и химических свойств элементов.
Хлор обладает сильными окислительными свойствами, и его взаимодействие с металлами часто приводит к образованию хлоридов. Этот процесс может протекать с выделением тепла и образованием соляных паров. Некоторые металлы, такие как натрий и калий, реагируют с хлором с фригорифическим эффектом, то есть сильным охлаждением.
Иод, в отличие от хлора, менее активен химически, но его взаимодействие с металлами также может протекать с образованием соответствующих соединений - иодидов. При этом процессе могут образовываться различные иодиды в зависимости от свойств металла и условий реакции. Например, иод вступает в реакцию с натрием, образуя натриевый иодид.
Взаимодействие хлора и иода с некоторыми металлами может приводить к образованию солей, которые имеют важное применение в различных отраслях промышленности и химии. Например, хлор и натрий реагируют, образуя натриевый хлорид - одну из основных компонент соли поваренной. Тогда как иод и натрий дают натриевый иодид, который используется в медицине и в фотохимической сфере.
Реакция хлора с металлами
Реакция хлора с металлами является одной из основных химических реакций, которая характеризуется образованием хлоридов металлов. Хлор является химически активным элементом и способен взаимодействовать с большим количеством металлов.
При контакте хлора с металлом происходит окислительно-восстановительная реакция. Хлор окисляет металл, отбирая у него электроны, в результате чего образуется хлорид металла, а сам хлор восстанавливается до ионного состояния.
Реакция хлора с металлами может происходить как при обычных температурах, так и при нагревании. Некоторые металлы, такие как натрий и калий, реагируют с хлором уже при комнатной температуре, в то время как другие металлы, например, железо и алюминий, требуют нагревания для запуска реакции.
Реакция хлора с металлами может протекать с разной степенью интенсивности. Некоторые металлы реагируют с хлором очень активно, проявляя жесткую реакцию в виде выделения пламени, в то время как у других металлов реакция может быть более медленной и незаметной.
Итак, реакция хлора с металлами является важным химическим процессом, с помощью которого можно получить различные хлориды металлов. Эта реакция имеет промышленное применение в процессе получения таких важных химических веществ, как хлорид натрия и хлорид алюминия.
Реакция иода с металлами

Иод - химический элемент, обладающий сильными окислительными свойствами. Он способен реагировать с различными металлами, образуя соединения. В зависимости от условий реакции ииода с металлами, происходят различные химические процессы.
Одним из широко известных примеров реакции иода с металлами является образование йодидов. В основном этот процесс протекает при нагревании иода с металлом в вакууме или при повышенных температурах. Образование йодидов происходит в результате процесса сублимации иода и его реакции с металлической поверхностью.
Реакция иода с некоторыми металлами может протекать спонтанно, без нагревания. Например, реакция иода с алюминием или цинком протекает уже при комнатной температуре. При взаимодействии иода с данными металлами образуются соединения - алюминиевый или цинковый йодид соответственно.
Однако, реакция иода с некоторыми металлами может быть менее интенсивной или даже отсутствовать. Например, реакция иода с железом или медью происходит очень медленно и требует дополнительных условий - нагревания или наличия катализаторов.
В целом, реакция иода с металлами зависит от их активности и электрохимического потенциала. Активные металлы, такие как алюминий и цинк, реагируют с иодом более интенсивно, образуя йодиды. Менее активные металлы, такие как железо и медь, могут реагировать с иодом только при определенных условиях.
Влияние металлической структуры на реакцию
Металлы характеризуются своей уникальной структурой, которая определяет их химические свойства и реакционную способность. Реакция металлов с хлором и иодом является одним из важных аспектов понимания этих свойств.
Структура металла влияет на скорость и характер реакции с хлором и иодом. Например, металлы, имеющие кубическую решетку, такие как натрий и калий, проявляют высокую реакционную способность. Это связано с особенностью их атомного строения и наличием свободных электронов, которые участвуют в химических реакциях.
Металлы, имеющие положительный заряд, такие как медь и железо, обычно реагируют с хлором и иодом медленнее. Это связано с тем, что положительные ионы металла притягивают анионы хлора и иода, образуя устойчивые соединения.
Некоторые металлические сплавы, такие как бронза или сплавы с содержанием алюминия, могут обладать другой структурой, чем чистые металлы. Это влияет на их реактивность с хлором и иодом и может привести к появлению новых свойств и характеристик соединений.
Также следует отметить, что температура также может оказывать влияние на реакцию металлов с хлором и иодом. При повышении температуры скорость реакции обычно увеличивается, например, цинк реагирует с хлором быстрее при высоких температурах, чем при низких.
Таким образом, металлическая структура играет важную роль в определении свойств и реакционной способности металлов при взаимодействии с хлором и иодом. Понимание этой зависимости помогает в разработке новых материалов и применении металлов в различных областях науки и технологии.
Факторы, влияющие на скорость реакции:

1. Концентрация веществ: Чем выше концентрация веществ, участвующих в реакции, тем быстрее протекает химическая реакция. Большая концентрация веществ обеспечивает большее количество их столкновений, что способствует увеличению скорости реакции.
2. Температура: Высокая температура повышает скорость реакции. При повышении температуры молекулы веществ получают большую энергию, что приводит к более частым и энергичным столкновениям и, как следствие, к увеличению скорости химической реакции.
3. Поверхность: Чем больше поверхность вещества, тем больше возможность для столкновения молекул и, следовательно, тем выше скорость реакции. Например, мелко раздробленный металл будет реагировать быстрее с химическими веществами, чем металл в виде крупных кусков, так как у него больше поверхности доступной для реакции.
4. Катализаторы: Наличие катализаторов может значительно повысить скорость реакции. Катализаторы ускоряют химические превращения, не участвуя самостоятельно в реакции. Они снижают энергию активации, необходимую для старта химической реакции, что позволяет ей протекать с большей скоростью.
5. Давление: Для газовых реакций меняющееся давление также может влиять на скорость реакции. Повышение давления приводит к увеличению концентрации газовых молекул, что стимулирует частые столкновения и, как следствие, повышает скорость реакции.
6. Свет: Для определенных химических реакций свет может быть фактором, влияющим на скорость. Некоторые вещества являются чувствительными к свету и при его воздействии начинают реагировать. В таких случаях свет может ускорять или замедлять скорость реакции, в зависимости от достаточности его постоянного воздействия.
7. Наличие ионов: Наличие ионов в реакционной среде может оказывать влияние на скорость реакции. Ионы могут играть роль в качестве катализаторов или специфически взаимодействовать с реагентами, ускоряя реакцию за счет образования сложных ионов.
8. Размер частиц: Размер частиц вещества также может влиять на скорость реакции. Более мелкие частицы имеют больше поверхности, что облегчает контакт и столкновения с другими частицами и ускоряет реакцию.
Практическое применение реакций хлора и иода с металлами

Реакции хлора и иода с металлами имеют широкое практическое применение в различных отраслях науки и техники. Одним из таких применений является получение солей. Благодаря своей высокой активности, хлор и иод реагируют с различными металлами, образуя соли, которые широко используются в химической промышленности.
Кроме того, реакции хлора и иода с металлами применяются в процессе очистки и обеззараживания воды. Хлор используется в качестве дезинфицирующего средства для уничтожения бактерий и вирусов. Иод используется в виде йодкалия или йодносодержащих соединений для обеззараживания воды и предотвращения развития болезней, связанных с недостатком иода.
Еще одним применением реакций хлора и иода с металлами является их использование в процессе получения органических соединений. Например, хлор используется в синтезе пластиков, резин и других полимерных материалов. Иод используется в органической химии, в том числе при получении лекарственных препаратов и красителей.
Кроме того, реакции хлора и иода с металлами применяются в пищевой промышленности. Хлор используется для дезинфекции пищевых продуктов и обработки пищевых контейнеров. Иод используется для обогащения пищевых продуктов и при производстве пищевых добавок, таких как йодированная соль.
Вопрос-ответ

Что происходит при реакции хлора с металлами?
При реакции хлора с металлами происходит образование хлоридов металлов. В зависимости от конкретных условий, реакция может проходить более или менее интенсивно.
Какие металлы реагируют с хлором?
С хлором реагируют многие металлы, но не все. Активные металлы, такие как натрий, калий, магний и алюминий, реагируют с хлором достаточно активно. Однако инертные металлы, такие как серебро или золото, не реагируют с хлором.
Какова роль хлора при реакции с металлами?
Хлор является окислителем при реакции с металлами. Во время реакции хлор принимает электроны от металла и превращается в ионы хлорида. Это обычно сопровождается выделением тепла и образованием белого дыма, состоящего из хлорида металла.
Можно ли использовать реакцию хлора с металлами в промышленности?
Да, реакцию хлора с металлами можно использовать в промышленности. Например, реакция хлора с алюминием применяется в производстве алюминия. Также хлор может использоваться для очистки металлических поверхностей от загрязнений.
