Хлор - химический элемент с атомным номером 17 и символом Cl. Он относится к группе химических элементов, называемых галогенами, которые включают также фтор, бром, йод и астат. Хлор обладает уникальными химическими свойствами, которые делают его важным элементом для различных промышленных процессов и научных исследований.
Одной из ключевых характеристик хлора является его высокая реакционная способность. Хлор обладает способностью образовывать химические соединения с большинством элементов в таблице химических элементов. Это свойство делает хлор хорошим окислителем и причиной многих химических реакций.
Хлор широко используется в промышленности и бытовых условиях. Например, хлор часто используется для производства пластиков, резиновых изделий и удаления микроорганизмов из воды в бассейнах и спа-салонах. Кроме того, хлор является частью многих средств по уходу за домом, в частности, в хлорсодержащих моющих средствах и отбеливателях.
Химические свойства хлора
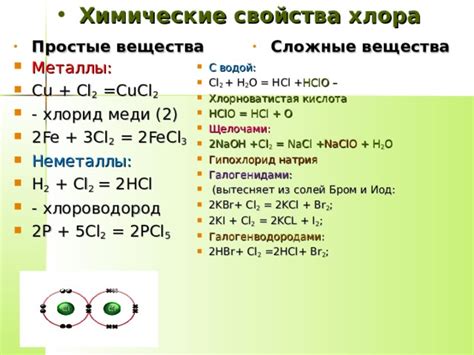
Хлор - химический элемент, который относится к галогенам. Имеет символ Cl и атомный номер 17. Хлор широко используется в различных отраслях, включая производство химических веществ, лекарств, пищевых добавок и многих других.
Хлор обладает мощным окислительным действием, что делает его эффективным при дезинфекции и очистке воды. Он может уничтожать бактерии, вирусы и другие микроорганизмы, что делает его неотъемлемым компонентом многих систем водоподготовки.
Хлор образует стабильные соединения с другими элементами, включая металлы. Он может образовывать соли с натрием, калием, магнием и другими металлами. Эти соединения широко применяются в производстве удобрений, стекла, пластмасс и других материалов.
Хлор наносит вред окружающей среде и здоровью человека, поэтому его использование должно быть контролируемым и осуществляться с соблюдением всех правил и нормативов.
Классификация галогенов
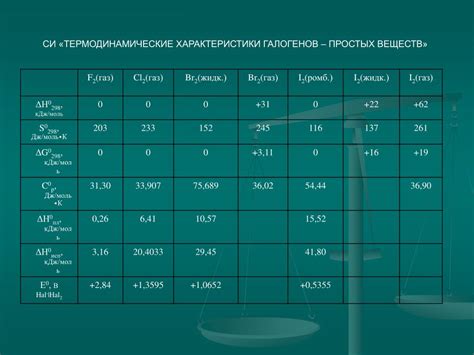
Галогены - это группа химических элементов, включающая в себя фтор (F), хлор (Cl), бром (Br) и йод (I). Они принадлежат к группе 17 (группа VIIA) периодической таблицы элементов. Галогены обладают уникальными химическими свойствами, которые определяют их важное место в химической промышленности и в целом в науке.
Первая характеристика галогенов - их электроотрицательность. Электроотрицательность хлора (3,16) и фтора (3,98) самая высокая среди всех химических элементов, что делает их сильными окислителями. В то же время, электроотрицательность брома (2,96) и йода (2,66) не так высока, но эти элементы также обладают свойствами окислителей.
Галогены элементарно образуют производные со многими другими элементами, такими как водород, кислород, сера и многие другие. Они также образуют соли с металлами, которые являются самыми распространенными структурами галогенов. Например, натрий хлорид (NaCl) и кальций фторид (CaF2) - обычные кристаллические соединения солей галогенов.
Галогены также известны своей способностью образовывать галогенированные углеводороды. При использовании галогенов в реакциях с углеводородами образуются соединения с хлором, бромом или йодом, которые имеют широкое применение в различных отраслях промышленности - от фармацевтики и пищевой промышленности до производства материалов и пластиков.
Реакции хлора с различными веществами

Хлор – это химическое вещество из группы галогенов, обладающее высокой химической активностью. Реакции хлора с различными веществами позволяют оценить его способность к взаимодействию с другими элементами и соединениями.
Взаимодействие хлора с металлами является одной из наиболее характерных реакций. Хлор образует с металлами соли, такие как хлориды. Например, хлор реагирует с натрием и образует хлорид натрия, NaCl. Эта реакция происходит с выделением ярко-желтого газа и сопровождается выпадением белого осадка.
Хлор также может взаимодействовать с нефтью, газами и другими органическими соединениями. Он проявляет свою высокую окислительную способность, что делает его эффективным при очистке воды и дезинфекции бассейнов. Взаимодействие хлора с органическими веществами может привести к образованию хлорированных органических соединений, некоторые из которых являются токсичными и опасными для жизни.
Реакции хлора с другими галогенами тоже являются интересным исследовательским объектом. Например, хлор и фтор могут образовывать хлорфторметаны. Эти соединения являются мощными органическими растворителями и часто используются в лабораториях и промышленности.
Таким образом, реакции хлора с различными веществами позволяют лучше понять его свойства и возможности применения в различных областях науки, промышленности и повседневной жизни.
Вопрос-ответ

Какие химические свойства имеет хлор?
Хлор – это химический элемент, который относится к группе галогенов. Он обладает высокоактивными свойствами. Хлор является очень реактивным элементом и способен образовывать множество соединений. Он легко расплавляется и испаряется, а также может образовывать соединения с большинством других элементов и соединений. Хлор реагирует с большинством металлов, образуя с ними хлориды.
Как классифицируется хлор как галоген?
Хлор относится к группе галогенов в периодической таблице элементов. Галогены – это группа элементов, которые находятся в 17-м группе периодической таблицы. Кроме хлора, в группе галогенов также входят фтор, бром, йод и астат. Галогены обладают высокоактивными химическими свойствами и образуют ион галогенида, который обладает отрицательным зарядом. Хлор является самым распространенным и важным элементом группы галогенов, который широко используется в различных отраслях промышленности и научных исследованиях.
