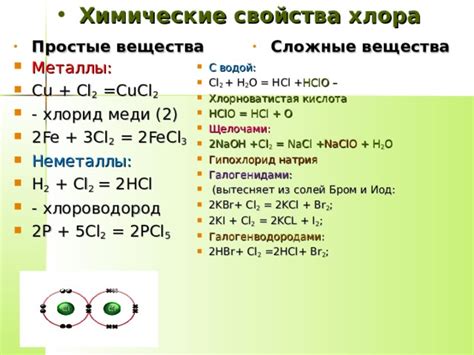
Хлор (Cl) – элемент химического элемента, который находится под номером 17 в таблице Менделеева и принадлежит к группе галогенов. Хлор представлен в периоде 3, который состоит из 8 элементов. Он является одним из самых известных и широко используемых элементов, который широко применяется в промышленности и других областях деятельности.
Хлор обладает низкой электроотрицательностью и является неметаллом. Это означает, что он обладает характеристиками неметалла, такими как непроводимость тепла и электричества, хрупкость, легкость образования соединений с металлами. Однако, хлор находится в окружении металлов в таблице Менделеева и географически располагается между металлами натрием и калием. Это может вызывать путаницу и вопросы о том, является ли хлор металлом или неметаллом.
Однако, несмотря на то, что хлор расположен вплотную к металлическим элементам, он все же является неметаллом. Его положение в таблице Менделеева обусловлено его электрохимическими и физическими свойствами. Хлор обладает высокой электроотрицательностью и является очень реактивным элементом, образуя сильные химические соединения с другими элементами. Это делает его хорошим окислителем и на реактивность в общем характерным для неметаллов.
Периодическая таблица Менделеева
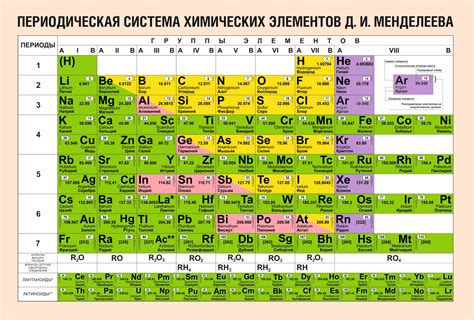
Периодическая таблица Менделеева – это основной инструмент в химии, который систематизирует информацию обо всех химических элементах. Эта таблица располагает элементы в порядке возрастания их атомных номеров и группирует их по их химическим и физическим свойствам.
В периодической таблице Менделеева элементы разделены на периоды и группы. Периоды – это горизонтальные строки, которые указывают на количество электронных оболочек в атомах элементов. На данный момент в таблице 7 периодов. Каждый последующий период начинается с новой электронной оболочки.
Группы – это вертикальные столбцы в таблице, которые указывают на количество электронов во внешней электронной оболочке. Номера групп могут быть от 1 до 18. Группы также имеют названия и особые свойства, которые отражаются в химических свойствах элементов.
Периодическая таблица Менделеева содержит информацию обо всех известных элементах, их атомных номерах, атомных массах, символах, электронной конфигурации, а также других важных данных. Эта таблица является ключевым инструментом для химиков и физиков, позволяющим легко находить необходимую информацию о свойствах и химическом поведении элементов.
Важной особенностью периодической таблицы Менделеева является то, что она помогает прогнозировать свойства новых и еще не открытых элементов, а также представлять их в рамках систематической классификации. Это позволяет исследователям и ученым проводить различные эксперименты и изучать взаимодействия элементов с другими веществами для создания новых материалов и развития науки в целом.
Номер периода хлора в периодической таблице
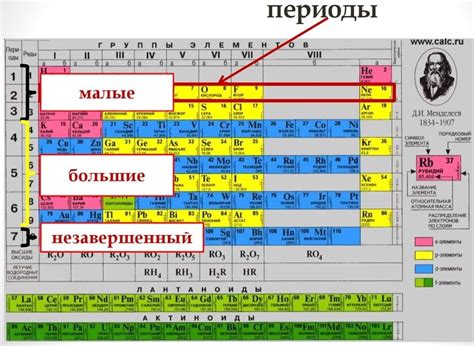
Хлор (Cl) расположен в периодической таблице Менделеева в 3-ем периоде. Периодическая таблица состоит из 7 периодов, которые горизонтально расположены от левого края таблицы к правому.
По номеру периода можно сделать вывод о том, что хлор является представителем третьей группы элементов. В данной группе хлор находится вместе с элементами, такими как фосфор и сера. Вместе эти элементы образуют химическую подгруппу неметаллов, известных также как галогены.
Хлор в периодической таблице обозначается символом Cl, а его атомный номер равен 17. Хлор является одним из наиболее распространенных химических элементов на Земле и имеет множество применений в области промышленности, медицины, сельского хозяйства и других сферах.
Расположение хлора в 3-ем периоде свидетельствует о его химических и физических свойствах, которые отличаются от свойств элементов, расположенных в других периодах. Знание номера периода элемента позволяет установить его положение в таблице, а также делает возможным анализ и сравнение его свойств с другими элементами.
Хлор: свойства и химические реакции

Хлор – элемент химической системы, относящийся к группе галогенов и расположенный в 17-м периоде таблицы Менделеева. Хлор является неметаллом.
У хлора есть ряд свойств и химических реакций, которые определяют его поведение в различных средах. Например, хлор является хорошим окислителем и легко взаимодействует с различными веществами.
Одним из наиболее известных свойств хлора является его отдушивающий запах, который обладает раздражающим действием на слизистые оболочки человека. Этот факт придает хлору отличительную особенность и определяет его использование в качестве дезинфицирующего средства и антисептика.
Хлор образует химические соединения с множеством элементов. Например, соединение хлора с натрием при комнатной температуре и давлении образует поваренную соль – хлорид натрия. Хлор реагирует с кислородом и образует хлороводородную кислоту. При взаимодействии хлора с водородом образуется соляная кислота.
Хлор имеет ряд применений в различных отраслях промышленности. Он используется в производстве химических веществ, таких как пластик, резина, пестициды и препараты для обработки воды. Также хлор находит применение при очистке бассейнов и водоемов, а также в процессе производства бумаги и текстиля.
В заключение, хлор – это неметалл, обладающий уникальными свойствами и способен вступать в химические реакции с различными элементами. Понимание его характеристик и взаимодействий позволяет использовать хлор в различных областях человеческой деятельности.
Хлор: химический элемент или соединение?

Хлор – это химический элемент с атомным номером 17 и символом Cl в таблице Менделеева. Он относится к галогенам, которые образуют класс элементов с очень высокой электроотрицательностью и хорошо выраженной агрессивностью к металлам.
Хлор является неметаллом и встречается в природе главным образом в виде молекул двухатомного газа Cl2. Однако, он также может образовывать различные соединения, такие как хлориды, сульфаты и другие. Хлор обладает разнообразными химическими свойствами и широко применяется в промышленности и быту.
Хлор широко используется в качестве дезинфицирующего, отбеливающего и консервирующего средства. Он применяется для очистки питьевой воды, обработки пищевых продуктов, производства пластмасс, резиновых изделий, препаратов для бассейнов и многого другого.
Хлор также используется в процессах химического синтеза для получения различных соединений. Например, хлористый водород (HCl) используется в производстве пластмасс, фармацевтических продуктов и других химических веществ.
Таким образом, хлор можно рассматривать как химический элемент, представленный в таблице Менделеева, и как активный компонент множества соединений, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
Физические свойства хлора
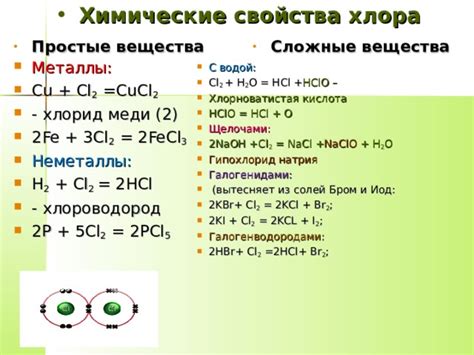
Хлор (Cl) - химический элемент, относится к группе галогенов в таблице Менделеева. Он имеет атомный номер 17 и общую массу 35,45 г/моль. Хлор является единственным неметаллом, находящимся в жидком состоянии при нормальных условиях температуры и давления.
Одним из физических свойств хлора является его ярко-желтая или желтовато-зеленая окраска. Этот элемент имеет характерный запах, который можно ощутить уже при небольшом количестве хлора в воздухе. Хлор обладает значительной плотностью и находится в состоянии газа при комнатной температуре, но при низких температурах и высоком давлении он может переходить в жидкое или даже твердое состояние.
Хлор обладает высокой растворимостью в воде, в результате чего получается соляная кислота. Кроме того, хлор может растворяться во многих органических растворителях, таких как этиловый спирт, бензол и уксусная кислота.
Хлор является очень реактивным элементом и образует множество соединений. Он обладает окислительными свойствами и может вступать во многие химические реакции. Хлор может образовывать соли с многими металлами, и эти соли широко используются в промышленности, включая производство пластиков, лекарств и удобрений.
- Точка плавления: -101,5°C;
- Точка кипения: -34,04°C;
- Плотность: 3,214 г/см³.
Очень малые концентрации хлора в воздухе позволяют использовать его как дезинфицирующее средство, особенно в бассейнах и системах для очистки воды. Однако большие концентрации хлора могут быть ядовитыми и опасными для здоровья.
Хлор в промышленности и повседневной жизни
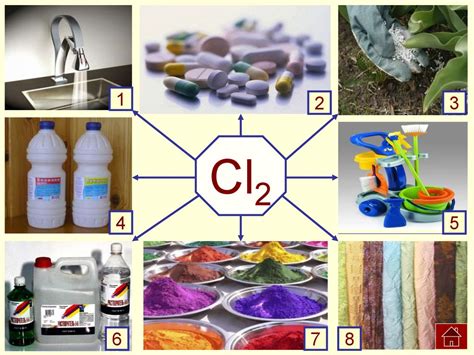
Хлор является одним из наиболее распространенных химических элементов, который широко используется в промышленности и повседневной жизни. Он имеет много полезных свойств и находит широкое применение в различных отраслях экономики.
В химической промышленности хлор используется для производства многих важных химических веществ. Например, он является основным сырьем для получения пластмасс, поливинилхлорида и хлорированных органических соединений. Хлор также используется для очистки воды в водопроводных и сточных системах, а также в процессе производства бумаги и текстиля.
В фармацевтической промышленности хлор используется для производства различных лекарственных препаратов. Он также является важным компонентом в процессе очистки и обеззараживания медицинского оборудования и помещений.
В повседневной жизни хлор используется в качестве дезинфицирующего средства для очистки воды в бассейнах и джакузи. Он также применяется для производства бытовых отбеливателей и чистящих средств, которые эффективно удаляют пятна и загрязнения с различных поверхностей.
Однако, несмотря на широкое применение хлора, важно помнить о его опасных свойствах. В высоких концентрациях хлор может быть токсичным и даже смертельным, поэтому необходимо соблюдать меры предосторожности при работе с ним. Кроме того, выбросы хлора в окружающую среду могут наносить вред здоровью и окружающей среде, поэтому необходимо контролировать их уровень и применять современные методы очистки и утилизации в процессе его использования.
Металлические и неметаллические элементы в таблице Менделеева
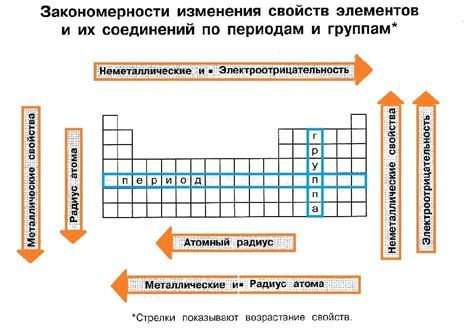
Периодическая система химических элементов представляет собой удобное средство для классификации различных веществ. В таблице Менделеева эти элементы разделены на несколько групп в зависимости от их свойств и химической активности. И одним из основных отличий между элементами является их металлический или неметаллический характер.
Металлы являются одной из крупнейших групп элементов в таблице Менделеева. Они обладают хорошей тепло- и электропроводностью, высокой пластичностью и твердостью. В таблице Менделеева металлы обычно располагаются слева и по центру, начиная с группы 1 (щелочные металлы) и заканчивая группой 15 (постпереходные металлы).
Неметаллы, в свою очередь, имеют противоположные свойства по сравнению с металлами. Они плохо проводят тепло и электричество, обладают низкой пластичностью и твердостью. В таблице Менделеева неметаллы обычно располагаются справа и сверху, начиная с группы 14 (углеродная группа) и заканчивая группой 18 (благородные газы).
Однако не все элементы в таблице Менделеева можно однозначно отнести к металлам или неметаллам. Некоторые элементы, такие как германий и антимон, находятся на границе между металлическим и неметаллическим характером и называются полуметаллами. Их свойства и активность зависят от условий окружающей среды и реакций с другими веществами.
В целом, различия между металлами и неметаллами в таблице Менделеева позволяют увидеть разнообразие свойств и возможностей химических элементов. Эта классификация помогает лучше понять, как взаимодействуют вещества и какие реакции могут происходить между ними.
Вопрос-ответ

В каком периоде расположен хлор в таблице Менделеева?
Хлор расположен во втором периоде таблицы Менделеева.
Является ли хлор металлом или неметаллом?
Хлор является неметаллом.