Азотная кислота (HNO3) является одним из наиболее распространенных химических соединений, которое часто используется в различных отраслях промышленности и в лабораториях. Одной из наиболее интересных областей применения азотной кислоты является ее взаимодействие с металлами.
При контакте азотной кислоты с металлами происходит ряд интересных химических реакций. В результате данных реакций металлы окисляются, приобретая положительный заряд. Азотная кислота служит окислителем, передавая свои электроны металлу. При этом образуются ионы металла и азота в различных степенях окисления.
Одним из наиболее распространенных примеров взаимодействия металлов с азотной кислотой является реакция меди. При добавлении азотной кислоты к меди образуется нитрат меди (Cu(NO3)2). Эта реакция широко используется в лабораторных условиях для получения нитратов металлов. Благодаря образующемуся нитрату медь может использоваться в процессе производства различных веществ, таких как пигменты, красители и многое другое.
Выводя их в газообразное состояние, азотная кислота также может утилизировать металлы. В результате реакции с алюминием, кислота образует оксид алюминия (Al2O3) и диоксид азота (NO2). Последний является токсичным, поэтому данная реакция нашла свое применение в процессе утилизации алюминиевых отходов, так как в результате реакции алюминий превращается в более безопасный оксид алюминия.
Химические реакции взаимодействия металлов с азотной кислотой
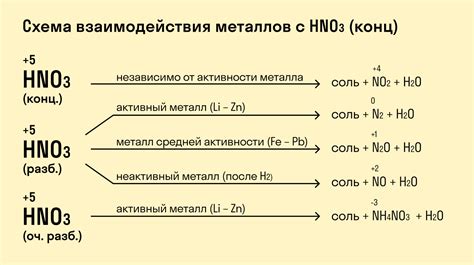
Взаимодействие металлов с азотной кислотой является одной из важных химических реакций. Оно протекает с образованием соответствующих солей и выделением оксидов азота. Эти реакции могут быть использованы в различных приложениях, таких как получение железных и медных солей, очистка металлической поверхности и т.д.
Взаимодействие железа с азотной кислотой приводит к образованию соли – нитрата железа(III) и оксида азота(II), который является одним из основных причин образования коричневого окраса при реакции.
В случае взаимодействия меди с азотной кислотой образуется нитрат меди(II) и оксид азота(II). Эта реакция может быть использована в процессе получения меди в лабораторных условиях.
Взаимодействие алюминия с азотной кислотой приводит к образованию нитрата алюминия и оксида азота(I). Оксид азота(I) может быть использован в качестве редуцирующего агента во многих химических процессах.
Таким образом, химические реакции взаимодействия металлов с азотной кислотой имеют значительную практическую значимость и широкое применение в различных областях науки и промышленности.
Механизм и особенности
Механизм взаимодействия металлов с азотной кислотой
Взаимодействие металлов с азотной кислотой основано на реакции окисления металла соответствующей кислотой. При этом происходит образование оксида металла или нитрозных газов, которые взаимодействуют с кислотой и дают соответствующие соли. Механизм этой реакции может зависеть от конкретного металла и его химических свойств.
Особенности взаимодействия металлов с азотной кислотой
- Скорость реакции зависит от активности металла. Более активные металлы, такие как натрий или калий, реагируют с азотной кислотой быстрее, чем менее активные металлы, такие как железо или медь.
- При взаимодействии металлов с азотной кислотой образуются соли, которые могут иметь различные химические и физические свойства. Например, нитраты, получаемые из реакции металлов с азотной кислотой, широко используются в промышленности.
- Реакция взаимодействия металлов с азотной кислотой может сопровождаться выделением тепла и образованием газа. Это свойство может быть использовано в различных химических процессах и технологиях, например, в качестве источника тепла или для обеспечения реакционной среды.
Таким образом, механизм взаимодействия металлов с азотной кислотой основан на реакции окисления металла и образовании соответствующих солей. Эта реакция имеет свои особенности, такие как зависимость скорости реакции от активности металла, образование газов и выделение тепла. Она также находит применение в различных сферах промышленности и технологий.
Вопрос-ответ

Как происходит взаимодействие металлов с азотной кислотой?
Взаимодействие металлов с азотной кислотой происходит через окислительно-восстановительные реакции. Металлы, обладающие высокой степенью активности, такие как натрий, калий, магний, реагируют с азотной кислотой, образуя соответствующие нитраты и выделяяся диоксид азота и вода.
Какие приложения имеет взаимодействие металлов с азотной кислотой?
Взаимодействие металлов с азотной кислотой имеет широкое применение в химической промышленности. Например, нитрат аммония, получаемый при реакции аммиака с азотной кислотой, используется в качестве удобрения. Также взаимодействие металлов с азотной кислотой может применяться в процессах синтеза различных химических соединений.
Можно ли использовать азотную кислоту для очистки металлических поверхностей?
Да, азотную кислоту можно использовать для очистки металлических поверхностей от окислов, солей и загрязнений. При этом следует учитывать, что азотная кислота является коррозионно-активным веществом, поэтому важно соблюдать меры предосторожности при использовании и правильно подбирать концентрацию кислоты и время воздействия.
