Металлы 2 группы - это элементы химической системы, которые можно найти во втором столбце периодической таблицы. Они характеризуются своими уникальными свойствами и имеют важное значение в различных промышленных и научных сферах. Металлы 2 группы обладают высокой электропроводностью и теплопроводностью, что делает их незаменимыми материалами в производстве проводов, проводников и различных электронных устройств.
Одним из основных свойств металлов 2 группы является их способность образовывать ионы с положительным зарядом. Эти ионы называются катионами и являются ключевыми построительными блоками металлических соединений. Кроме того, металлы этой группы обладают характерной реакцией с кислородом - они способны образовывать оксиды, которые широко используются в металлургической и строительной отраслях.
Металлы 2 группы обладают высокой пластичностью и могут быть легко прокатаны или вытянуты в проволоку или лист. Они также обладают высокой плотностью, что делает их тяжелыми материалами. Эта группа металлов включает в себя такие элементы, как магний, цинк, кадмий и ртуть. Каждый из них имеет свои уникальные характеристики и найдет свое применение в различных сферах нашей жизни.
Металлы 2 группы в химии 9 класса: Общая характеристика

Металлы 2 группы в химии 9 класса представлены несколькими элементами: цинком (Zn), кадмием (Cd) и ртутью (Hg). Они обладают рядом особенностей и общих свойств, которые позволяют их отнести к одной группе.
Цинк – мягкий блестящий металл серебристо-голубого цвета, хорошо ведет тепло и электричество. Он обладает низкой плавкостью и легко поддается обработке. Цинк используется в промышленности для оцинковки, а также в производстве литейных сплавов и батареек.
Кадмий – серебристо-белый металл сине-голубого оттенка. Он имеет низкую плавкость и хорошо растворим в кислотах. Кадмий применяется в производстве аккумуляторов, пигментов для красок и пластиков, а также в электронной промышленности.
Ртуть – единственный жидкий металл в обычных условиях. Ее химический символ Hg происходит от латинского названия ртути – hydrargyrum. Ртуть ядовита и испаряется при комнатной температуре, поэтому требует особого обращения. В medic производстве ртуть используется в градусниках, полупроводниковой промышленности и других технических процессах.
Вывод: Металлы 2 группы – цинк, кадмий и ртуть – обладают некоторыми общими свойствами и характеристиками. Они являются блестящими, ведут тепло и электричество, а также могут быть использованы в различных отраслях промышленности. Подробное изучение их свойств и химических связей позволяет понять их уникальность и применение в различных областях.
Определение и классификация металлов
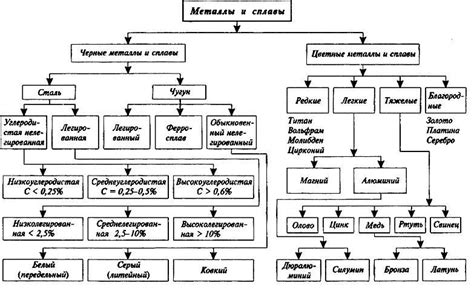
Металлы - это химические элементы, обладающие своеобразными свойствами. Они характеризуются высокой теплопроводностью и электропроводностью, металлическим блеском и способностью образовывать положительные ионы, известные как катионы. В химии металлы обычно делят на две группы: группу 1 и группу 2.
Металлы 1 группы представлены следующими элементами: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают низкой плотностью, низкой температурой плавления и кипения, а также низкой твердостью. Они воспламеняются при контакте с водой, образуя водород.
Металлы 2 группы включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы уже более плотные, имеют более высокую температуру плавления и кипения, а также более высокую твердость. Они активны химически и способны образовывать соединения.
Металлы обладают широким спектром применения в промышленности и повседневной жизни. Они используются для производства различных металлических изделий, электроники, автомобилей, строительных материалов и многого другого. Изучение металлов и их свойств является важным компонентом курса химии и позволяет понять принципы их использования и обработки.
Физические свойства металлов
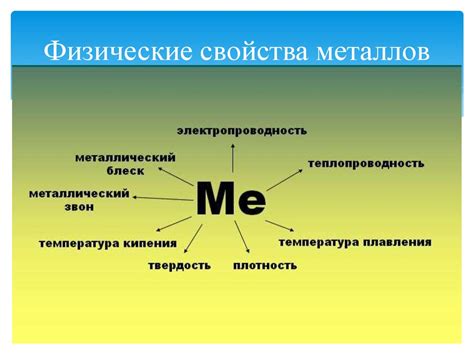
Металлы - это химические элементы, характеризующиеся определенными физическими свойствами. Вот некоторые из них:
- Проводимость электричества и тепла: Металлы обладают высокой электрической и тепловой проводимостью. Это позволяет им передавать электричество и тепло с высокой эффективностью. Большинство металлов являются хорошими проводниками электричества и тепла.
- Пластичность: Металлы обладают способностью к деформации без разрушения. Они могут быть легко прокатаны в листы или вытянуты в проволоку, что делает их очень гибкими и удобными для использования в различных областях.
- Металлический блеск: Металлы, подвергнутые полировке, обладают характерным блеском, который называется металлическим блеском. Он связан с особенностями строения кристаллической решетки металлов.
- Высокая плотность: Металлы имеют высокую плотность, что означает, что они обладают большой массой в отношении своего объема. Это обусловлено компактной упаковкой атомов металла в кристаллической решетке.
- Высокая температура плавления и кипения: Большинство металлов обладают высокой температурой плавления и кипения. Это делает их полезными в высокотемпературных процессах, таких как плавка и отливка.
Вывод: Металлы обладают некоторыми характеристиками, которые делают их уникальными и полезными для различных применений. Изучение физических свойств металлов помогает понять, почему они обладают такими уникальными свойствами и как они могут быть использованы в различных областях науки и промышленности.
Химические свойства металлов

Металлы обладают рядом характерных химических свойств, которые определяют их уникальные свойства и применение в различных сферах жизни.
1. Реакция с водой. Некоторые металлы (например, натрий, калий) довольно активно реагируют с водой, выделяя горючий газ водород и образуя щелочь. Другие металлы (например, железо, алюминий) не реагируют с водой при обычных условиях.
2. Реакция с кислотами. Большинство металлов реагируют с кислотами, выделяя газ водород и образуя соли. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя водород.
3. Коррозия. Многие металлы подвержены коррозии - медленному окислению воздухом или другими веществами. Например, железо окисляется при воздействии влаги и кислорода, образуя ржавчину.
4. Способность образовывать соединения. Металлы обладают способностью образовывать различные типы соединений, такие как оксиды, сульфиды, хлориды и другие. Эти соединения широко используются в промышленности и науке.
5. Проводимость электричества и тепла. Металлы являются хорошими проводниками электричества и тепла благодаря своей структуре, в которой свободные электроны могут легко передвигаться.
6. Способность образовывать сплавы. Металлы могут образовывать сплавы с другими металлами или неметаллами, что позволяет создавать материалы с новыми свойствами и характеристиками.
Однако каждый металл имеет свои особенности и может проявлять другие химические свойства, которые не упомянуты в данном списке.
Особенности металлов 2 группы

Металлы 2 группы характеризуются рядом особенностей, которые делают их уникальными в химическом мире. Эти металлы, такие как цинк, кадмий и ртуть, обладают своеобразными физическими и химическими свойствами.
Во-первых, металлы 2 группы имеют низкую плотность и мягкие свойства. Например, цинк – легкий и гибкий металл, который легко поддается обработке. Кадмий также обладает схожими свойствами – он мягкий и пластичный, что делает его идеальным для использования в различных отраслях промышленности.
Во-вторых, металлы 2 группы обладают высокой реактивностью. Цинк, например, активно взаимодействует с кислотами, образуя соли. Кадмий и ртуть также проявляют схожую реактивность и растворяются в кислотах с образованием солей.
В-третьих, металлы 2 группы обладают характерными химическими свойствами. Ртуть, например, является единственным металлом, который при комнатной температуре находится в жидком состоянии. Кадмий и цинк, в свою очередь, имеют плавящиеся точки ниже, чем у большинства других металлов.
Металлы 2 группы являются важными элементами в промышленности и находят широкое применение в различных отраслях, таких как электроника, машиностроение и медицина. Их уникальные свойства делают их незаменимыми материалами для производства различных изделий и компонентов.
Примеры металлов 2 группы
К металлам 2 группы относятся основные металлы – металлы, образующие основную часть распространенных металлически сложенных минералов. Примеры металлов 2 группы включают в себя следующие элементы: кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Кальций (Ca) – это серебристо-белый металл, который является одним из самых распространенных элементов в земной коре. Он используется в различных областях, включая строительство, производство стекла и фармацевтику.
Стронций (Sr) – это блестящий серебристо-белый металл, который обладает высокой реактивностью. Он применяется в производстве пиротехнических изделий, включая светящиеся краски и радиоактивный маркер на часах.
Барий (Ba) – это мягкий серебристо-белый металл, который используется в качестве смазки в вакуумных системах, а также в производстве специальных стекол и красителей.
Радий (Ra) – это радиоактивный металл, который имеет свойства, позволяющие его использовать в медицине, радиотерапии и научных исследованиях.
Использование металлов 2 группы в промышленности

Металлы 2 группы периодической системы, такие как магний (Mg), цинк (Zn) и кадмий (Cd), широко используются в различных отраслях промышленности благодаря своим уникальным свойствам и химической активности.
Один из основных способов использования металлов 2 группы - производство сплавов. Магний, например, часто используется в производстве алюминиевых сплавов, которые отличаются легкостью, прочностью и стойкостью к коррозии. Такие сплавы широко применяются в авиационной и автомобильной промышленности, а также в производстве спортивных товаров, таких как рамы велосипедов и гольф-клюшки.
Цинк, в свою очередь, находит применение в гальванической промышленности. Благодаря своей высокой коррозионной стойкости, цинк используется для создания защитных покрытий на металлических изделиях, таких как крыши, трубы и заклепки. Также цинк широко используется в производстве батареек, гальванических элементов и других электротехнических устройств.
Кадмий, хотя и является редким металлом, также находит применение в промышленности. Его основное использование связано с производством аккумуляторов и гальванических элементов, так как кадмий обладает высокой электропроводностью и способностью к химическим реакциям.
Выводы и значения изучения металлов 2 группы в химии 9 класса

Изучение металлов 2 группы в химии 9 класса играет важную роль в формировании основ химического знания и развитии научного мышления у учащихся. Познакомившись с характеристиками и свойствами этих металлов, они могут лучше понять строение вещества и его взаимодействие.
Первый вывод заключается в том, что металлы 2 группы химической классификации обладают низкой активностью. Это значит, что они мало реактивны и возможны только некоторые реакции с кислородом воздуха и водой.
Второй вывод состоит в том, что металлы 2 группы образуют соединения с кислородом, образуя оксиды. Оксиды этих металлов часто используются в промышленности в качестве катализаторов, а также их сплавы находят применение в различных отраслях промышленности.
Третий вывод связан с устойчивостью металлов 2 группы в различных средах. Они не окисляются в сухом воздухе, не выделяются из растворов простых кислот и солей, что делает их устойчивыми к коррозии и позволяет использовать их в создании различных конструкций и механизмов.
Четвертый вывод отражает значение изучения металлов 2 группы для понимания процессов электролиза. Металлы этой группы обладают положительным электрическим потенциалом и могут быть получены методом электролиза из соединений в расплавленном состоянии, что применяется в промышленности для производства различных металлических изделий и материалов.
Таким образом, изучение металлов 2 группы в химии 9 класса имеет важное значение для формирования базовых знаний о строении вещества, металлургии и электрохимии, а также для расширения кругозора учащихся и развития их научного мышления.
Вопрос-ответ

Какие металлы относятся к 2 группе в химии?
Ко 2 группе металлов в химии 9 класса относятся металлы щелочноземельных элементов, а именно: магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Каково строение атомов металлов из 2 группы?
Атомы металлов 2 группы обладают основным строением - электронная конфигурация, в которой валентная оболочка содержит 2 электрона.
