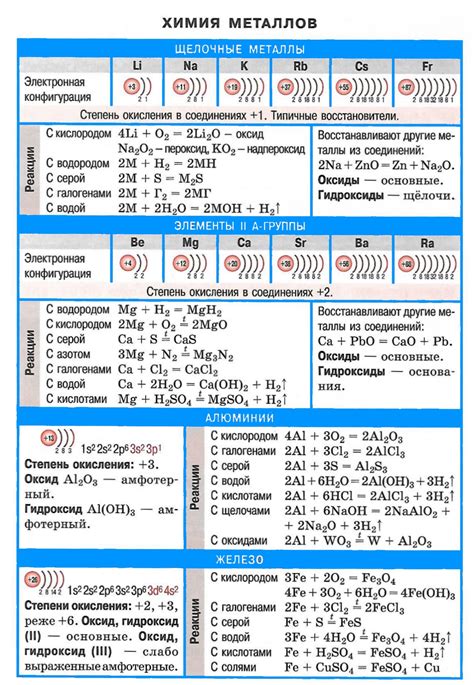
Щелочные металлы - это элементы периодической таблицы, которые относятся к первой группе. В состав щелочных металлов входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они называются щелочными, потому что образуют щелочные оксиды и щелочные гидроксиды при взаимодействии с водой.
Формула лития - Li. Литий является легким и реактивным металлом, широко используется в аккумуляторах и в некоторых лекарствах. Он является металлом с малым атомным радиусом и малой плотностью.
Формула натрия - Na. Натрий - это очень распространенный металл, который используется в производстве щелочей, стекла и многих других химических соединений. Натрий легко реагирует с водой, образуя водород и щелочь.
Формула калия - K. Калий - это металл, который обладает хорошей гидратной оболочкой, что делает его ион более мобильным и большим, чем у лития и натрия. Калий используется в удобрениях и при производстве стекла.
Формула рубидия - Rb. Рубидий является металлом, который обладает сходными свойствами с калием и натрием. Он используется в резисторах и фотоэлементах, а также в исследованиях, связанных с атомными часами и лазерами.
Формула цезия - Cs. Цезий - это металл, который имеет уникальные свойства, такие как наиболее низкую рабочую температуру и самую высокую плотность среди всех щелочных металлов. Цезий используется в электронике, измерении времени и в медицине.
Формула франция - Fr. Франций является самым тяжелым и реактивным металлом среди щелочных металлов. Его изотопы обладают очень короткими периодами полураспада. Франций используется в исследованиях, в которых требуется очень высокая радиоактивность.
Свойства и химические реакции щелочных металлов
Щелочные металлы - это группа химических элементов, включающих литий, натрий, калий, рубидий, цезий и франций. Они являются самыми активными металлами в периодической системе и обладают рядом уникальных свойств.
Первое свойство щелочных металлов - их высокая реакционная способность. Они легко реагируют с водой, кислородом и некоторыми другими веществами. Эта реакционная способность объясняется низкой энергией ионизации и большим радиусом атомов щелочных металлов.
Второе свойство щелочных металлов - образование гидроксидов, или щелочей, при реакции с водой. Гидроксиды щелочных металлов обладают щелочными свойствами, то есть они растворяются в воде, образуя щелочные растворы с высокими значениями pH. Это свойство делает щелочные металлы важными веществами в промышленности и в бытовой химии.
Третье свойство щелочных металлов - образование солей при реакции с кислотами. Щелочные металлы обладают основными свойствами и реагируют с кислотами, образуя соли и воду. Это происходит по принципу нейтрализации - щелочь и кислота взаимно нейтрализуются, образуя нейтральную соль.
Четвертое свойство щелочных металлов - способность образовывать сплавы с другими металлами. Щелочные металлы могут образовывать сплавы с другими металлами, что позволяет использовать их в промышленности для создания различных материалов и сплавов с заданными свойствами.
Пятое свойство щелочных металлов - высокая энергетическая активность. В результате своей реакционной способности, щелочные металлы могут взрываться при контакте с водой или кислородом. Управляемое использование этого свойства применяется, например, в батарейках и аккумуляторах.
Периодическая система и положение щелочных металлов
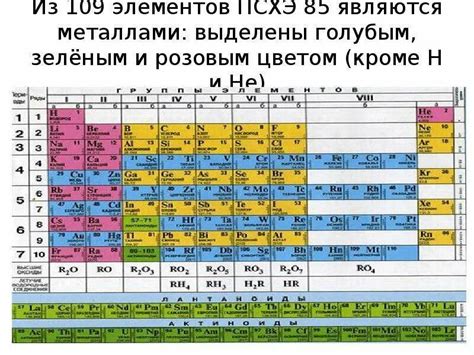
Периодическая система элементов – это систематическое расположение химических элементов по возрастанию атомного номера и периодам в виде таблицы. В ней важное место занимают щелочные металлы, которые находятся в первой группе (I А) и состоят из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr).
Щелочные металлы характеризуются рядом особенностей. Все они обладают одним валентным электроном во внешней электронной оболочке и легко отдают его, образуя положительные ионы. Это связано с тем, что у них сверху на столом расположена только одна оболочка электронов, а уровень энергии этого электрона находится на достаточно большом расстоянии от положительно заряженного ядра.
В свободном состоянии щелочные металлы представлены мягкими металлами серебристо-белого цвета. Они хорошо проводят тепло и электричество, легко реагируют с водой, образуя щелочные растворы, выделяются взрывным сжиганием и имеют малую плотность. Как правило, они находятся в природе в виде ионов, связанных с различными анионами.
Щелочные металлы обладают различными применениями. Так, натрий широко используется в пищевой промышленности и производстве мыла, а также в качестве активатора для некоторых реакций. Калий используется в удобрениях, цезий применяется в научных исследованиях и электронике, а также как источник излучения в радиотерапии. Литий также используется в батарейках и лекарственных препаратах.
Способы получения щелочных металлов

Электролиз в расплаве щелочных хлоридов. Щелочные металлы, такие как натрий и калий, можно получить путем электролиза их хлоридных соединений в расплаве. Для этого в электролизере помещается смесь хлорида металла с хлоридом кальция или хлорида натрия в виде плавиковой соли. При прохождении электрического тока через эту смесь, металлы переходят на катод, а хлор выделяется на аноде.
Редукция оксидов щелочных металлов. Другим способом получения щелочных металлов является их редукция из оксидных соединений. Основной реактив для редукции оксидов натрия и калия - это углерод, который образует угарный штейн или дымку при воздействии высокой температуры. При реакции углерода с оксидами натрия и калия образуются соответствующие металлы и угарный газ.
Химическая реакция с водородом. Одним из способов получения щелочных металлов является их реакция с водородом. Металл взаимодействует с водородом при высокой температуре, образуя соответствующую металлическую соль и выделяяся водород. Подобным образом можно получить натрий и калий из их соответствующих хлоридов, реагируя с водородом.
Реакция с азотом. Еще одним способом получения щелочных металлов является их реакция с азотом. При нагреве металла с азотом происходит образование нитрида металла. Для получения нитрида натрия и калия применяется электрохимический метод, при котором металл восстанавливается из галогенида в расплаве, а затем реагирует с азотом для образования нитрида.
- Электролиз в расплаве щелочных хлоридов
- Редукция оксидов щелочных металлов
- Химическая реакция с водородом
- Реакция с азотом
Особенности хранения и использования щелочных металлов

Щелочные металлы - это элементы, которые характеризуются высокой химической активностью и реактивностью. Поэтому при хранении и использовании их необходимо соблюдать определенные меры предосторожности.
Во-первых, щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, очень реагируют с водой. При контакте с водой они могут выделять большое количество водорода и сильно нагреваться, что может привести к возгоранию или даже взрыву. Поэтому хранить их следует в сухих и хорошо закрытых контейнерах.
Во-вторых, щелочные металлы довольно активно реагируют с воздухом. Они могут быстро окисляться и покрываться слоем оксида, что влияет на их свойства. Поэтому при использовании их необходимо защищать от воздействия воздуха.
В-третьих, щелочные металлы обладают высокой электропроводностью, поэтому подходят для использования в электрохимических и электротехнических процессах. Однако при работе с ними необходимо быть осторожными и использовать средства защиты, так как они могут вызывать ожоги при контакте с кожей или слизистыми оболочками.
Также следует отметить, что щелочные металлы используются в производстве сплавов, солей, щелочных батарей и других продуктов. Важно правильно выбирать их для конкретных целей и соблюдать меры безопасности при работе с ними.
Применение щелочных металлов в промышленности и научных исследованиях
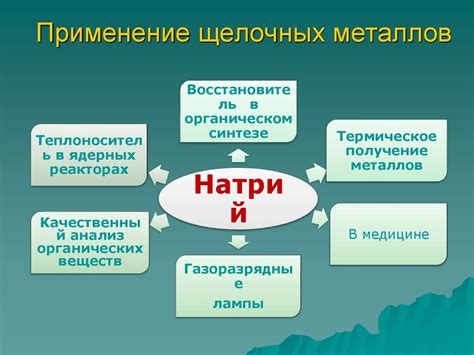
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в различных областях промышленности и научных исследований. Они отличаются высокой активностью, химической реакционностью и способностью образовывать растворимые гидроксиды.
Одним из главных применений щелочных металлов в промышленности является их использование в производстве щелочей, таких как гидроксид натрия (NaOH) и гидроксид калия (KOH). Щелочи широко применяются в производстве стекла, мыла, моющих средств, а также в обработке металлов и различных химических процессах.
Кроме того, щелочные металлы часто используются в батареях и аккумуляторах, так как они обладают высокой электроотрицательностью и могут служить источниками электрической энергии. Литий-ионные аккумуляторы, содержащие литий, на сегодня являются одним из наиболее распространенных типов аккумуляторов.
В научных исследованиях щелочные металлы также играют важную роль. Они используются в качестве катализаторов в различных химических реакциях и синтезе органических соединений. Например, металлы натрия и калия могут быть использованы для проведения реакции Гриньяра, которая позволяет введение органических групп в молекулы соединений.
Кроме того, щелочные металлы применяются в специализированных научных исследованиях в области атомной физики. Например, рубидий и цезий используются в атомных часах и лазерах, так как они обладают стабильными изотопами и высокой электронной плотностью.
Таким образом, щелочные металлы играют важную роль в промышленности и научных исследованиях. Их химическая активность и уникальные свойства позволяют использовать их в различных областях, от производства щелочей до разработки новых технологий и научных открытий.
Химический анализ щелочных металлов

Химический анализ щелочных металлов - важная часть изучения и определения свойств этих элементов. Щелочные металлы представляют особый интерес для химиков из-за их активности и способности образовывать соли и основания. Химический анализ позволяет определить содержание и состав щелочных металлов в различных образцах и реакционных смесях.
Одним из основных методов химического анализа щелочных металлов является гравиметрический анализ. При этом методе процентное содержание металла определяется путем измерения его массы после осуществления определенной химической реакции. Например, для определения содержания калия можно использовать реакцию с тетраоксомарганатом калия, которая приводит к образованию осадка, масса которого позволяет вычислить количество калия.
Еще одним широко используемым методом анализа щелочных металлов является комплексометрический анализ. Он основан на реакциях образования стабильных комплексов с ионами щелочных металлов. Через использование соответствующих индикаторов и титрирования реакционных смесей, можно точно определить концентрацию металлов в растворах.
Наиболее точным и современным методом химического анализа щелочных металлов является спектрометрический анализ. Он основан на изучении оптических свойств атомов щелочных металлов. С помощью спектрометров можно точно определить тип и количество элементов в образце. Такой анализ позволяет идентифицировать отдельные металлы и даже установить наличие следовых элементов.
Таким образом, химический анализ щелочных металлов представляет собой комплекс методов, позволяющих точно определить содержание и состав этих элементов. Это важная информация для понимания и использования свойств щелочных металлов в различных областях науки и промышленности.
Значение щелочных металлов в природе и жизни человека

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль как в природе, так и в жизни человека. Они являются неотъемлемыми компонентами многих минералов, солей и органических соединений. Щелочные металлы широко распространены в земной коре и морских водах, и они обладают уникальными свойствами и способностями.
В природе, щелочные металлы играют важную роль в межатомных реакциях, солевом обмене, биологических процессах и структурных свойствах различных минералов. Например, натрий и калий являются необходимыми катионами для многих живых организмов, включая растения и животных. Литий, в свою очередь, обладает способностью участвовать в химических реакциях, связанных с регулированием биологических процессов в организмах.
В жизни человека, щелочные металлы имеют широкое применение в различных отраслях. Натрий является основным компонентом кухонной соли, которая используется для соления и приготовления пищи. Калий необходим для нормального функционирования мышц и сердца, и его дефицит может привести к нарушениям в работе организма. Литий используется в фармакологии в виде лекарственного препарата для лечения психических заболеваний, таких как биполярное расстройство.
В заключение, щелочные металлы имеют значительное значение и в природе, и в жизни человека. Они обладают уникальными свойствами и широко применяются в различных областях, от химической промышленности до медицины. Знание и понимание роли этих элементов помогает нам лучше управлять ими и использовать их в нашу пользу.
Вопрос-ответ

Какие щелочные металлы существуют?
Существует пять щелочных металлов: литий, натрий, калий, рубидий, цезий.
Какие формулы у щелочных металлов?
Формулы щелочных металлов выглядят следующим образом: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs).
Какие свойства имеют щелочные металлы?
Щелочные металлы являются химически активными и реагируют с водой, кислородом и кислотами. Они имеют низкую плотность и низкую температуру плавления. Щелочные металлы также обладают хорошей электропроводностью и используются в производстве батареек.
Какую роль играют щелочные металлы в природе и промышленности?
Щелочные металлы играют важную роль в природе и промышленности. Например, натрий используется в производстве стекла и моющих средств, а калий используется в удобрениях и производстве мыла.
