Химическое взаимодействие металлов с солями является одним из основных процессов в химии. Металлы имеют способность реагировать с солями различных кислот, таких как соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3) и другие. В результате этих реакций могут образовываться новые соединения, которые могут иметь различные физические и химические свойства.
Принцип взаимодействия металлов с солями основан на способности металлов отдавать электроны. Металлы часто действуют как восстановители, т.е. они отдают электроны и переходят в положительное оксидационное состояние. В то же время соли являются окислителями, они принимают электроны и переходят в отрицательное оксидационное состояние. Таким образом, в результате реакции происходит обмен электронами между металлом и солью.
В зависимости от конкретных условий и химических свойств металла и соли, могут образовываться различные продукты реакций. Например, при взаимодействии металла с соляной кислотой образуется хлорид металла и выделяется водород. А при реакции с металлом нитратной кислотой образуется нитрат металла и выделяется оксид азота.
Важно отметить, что не все металлы могут реагировать с солями. Некоторые металлы, такие как золото и платина, обладающие высокой химической инертностью, не образуют стабильные соединения с солями. Однако большинство металлов, включая железо, алюминий, медь, цинк и магний, активно взаимодействуют с солями и могут быть использованы в различных промышленных и химических процессах.
Изучение химического взаимодействия металлов с солями имеет большое значение не только с точки зрения науки, но и в практическом применении. Эти реакции лежат в основе таких процессов, как гальваническая коррозия металлов, электрохимические процессы, процессы извлечения и очистки металлов, а также в производстве различных химических соединений и материалов.
Химическое взаимодействие металлов с солями

Химическое взаимодействие металлов с солями является одним из основных принципов химии и является важной составляющей многих реакций. Металлы часто реагируют с солями, образуя различные соединения и инициируя разнообразные химические процессы.
Металлы могут реагировать со солями различными способами. Один из часто встречающихся типов реакций - обмен реакция, когда ионы металла замещают ионы в соли. Например, медь и железо могут реагировать с растворами солей, замещая соответствующие металлы и образуя новые соединения.
Реакции металлов с солями могут иметь различные последствия. Некоторые реакции приводят к образованию осадка, который может быть дальше использован для выделения и определения металла. Другие реакции могут приводить к образованию газов или обсуживанию соляных растворов, что может иметь практическое значение в различных промышленных процессах.
Соли, которые реагируют с металлами, обычно содержат одно- и двухвалентные катионы. Металлы с определенным степенями окисления могут реагировать только с определенными катионами. Кроме того, реакционные условия, такие как pH и температура, также могут влиять на химическую реакцию между металлом и солью.
Химическое взаимодействие металлов с солями является важным аспектом химической науки и имеет широкий диапазон применений в различных областях, включая аналитическую химию, металлургию, нанотехнологии и промышленность. Изучение этих реакций позволяет лучше понять химические свойства металлов и разрабатывать новые способы их применения.
Основные принципы реакций
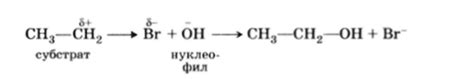
Химическое взаимодействие металлов с солями основано на реакциях окисления и восстановления. В процессе реакции металл отдает свои электроны, становясь ионом положительного заряда (катионом), а соль принимает эти электроны, становясь ионом отрицательного заряда (анионом).
Основными факторами, влияющими на протекание реакции, являются реакционная активность металлов и реактивность солей. Чем активнее металл, тем проще ему отдать электроны и протекает реакция с солью с большей интенсивностью.
Также важным фактором является концентрация реагентов. При высокой концентрации соли и металла реакция может протекать быстро и энергично. Однако, чрезмерная концентрация соли или металла может привести к образованию осадков и затруднить протекание реакции.
Большое значение имеет также pH среды. Некоторые реакции металлов с солями проходят только при определенных значениях pH. Например, реакция цинка с серной кислотой происходит при нейтральной или слабощелочной среде.
Изучение основных принципов реакций металлов с солями позволяет понять, как происходят эти реакции, предсказывать их результаты и использовать их в различных областях, связанных с химией металлов и солей.
Реакции соляных соединений с металлами

Реакции соляных соединений с металлами являются одним из основных методов получения металлов, а также имеют широкое применение в различных отраслях промышленности и науки. В химии солями называют кислотные соединения, образованные при замене водорода в кислоте металлом, таким образом, соли представляют собой соединения металлов с анионом.
Реакции соляных соединений с металлами могут происходить различными способами. Одним из наиболее распространенных является образование солей при взаимодействии металлов с кислотами. В этом случае металл вытесняет водород из кислоты, образуя с ее анионами соли. Реакция протекает с выделением газа, что позволяет удобно наблюдать ее ход. Примером такой реакции является взаимодействие цинка с соляной кислотой: Zn + 2HCl → ZnCl2 + H2.
- Еще одним способом реакций соляных соединений с металлами является образование солей при взаимодействии металлов с основаниями. В этом случае металл вытесняет металлический катион из основания, образуя с его анионами соли. Примером такой реакции является взаимодействие цинка с гидроксидом натрия: Zn + 2NaOH → Na2ZnO2 + H2O.
- Также реакции соляных соединений с металлами могут происходить при взаимодействии соляных растворов с металлическими порошками. В этом случае металлический порошок образует с солью новое соединение. Примером такой реакции является взаимодействие алюминия с сульфатом меди: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu.
Кроме того, реакции соляных соединений с металлами могут протекать при взаимодействии соляных растворов и металлических стержней. В этом случае происходит электрохимическая реакция, в результате которой на металлическом стержне образуется слой отложенного металла. Примером такой реакции является цинкование железа с использованием раствора цинка.
Ионные реакции между металлами и солями

Химическое взаимодействие металлов с солями основано на образовании ионных связей, при которых происходят реакции обмена ионами между металлическими и кислотными ионами. Эти реакции часто включают в себя окислительно-восстановительные процессы и могут приводить к формированию осадков, новых соединений или просто образованию растворов с ионами металла.
В результате ионных реакций, между металлами и солями, металлические ионы обычно замещают кислотные ионы в соли, образуя тем самым новую соль. Это процесс известен как двойная замена или метатезис. Например, при реакции между медью и раствором серной кислоты образуется раствор сульфата меди и выделяется газ диоксид серы.
Некоторые металлы, такие как цинк или железо, могут проявлять свойство присоединяться к кислородным ионосферам, замещая атомы водорода и образуя воду. Это особенно ярко проявляется при реакции железа с солями кислорода, где образуется раствор сульфата железа и выделяется газ кислорода.
Некоторые ионные реакции, между металлами и солями, могут быть сопровождаемы образованием осадков. Например, при реакции между свинцом и раствором хлорида натрия образуется хлорид свинца, который может выпасть в виде белого осадка. Это явление часто используется для анализа наличия определенных металлов в растворах.
Образование солей в химических реакциях с металлами

Химическое взаимодействие металлов с солями является одним из важных механизмов образования солей. В химических реакциях, происходящих между металлами и солями, металл замещает в составе соли другой металл, образуя новое соединение - соль.
Образование солей в химических реакциях с металлами основано на принципе замещения металлов в реакции. Более активные металлы могут замещать менее активные металлы в составе солей, что приводит к образованию новых соединений. Например, при взаимодействии меди (Cu) с соляной кислотой (HCl), образуется соль меди (CuCl2) и выделяется водород (H2).
Образование солей в химических реакциях с металлами может происходить также через обмен ионами. В данном случае, ионы металла из соли замещают ионы металла, находящегося в растворе или в другом соединении. Этот процесс может быть иллюстрирован на примере реакции образования карбоната кальция (CaCO3) при взаимодействии карбоната натрия (Na2CO3) с сульфатом кальция (CaSO4).
Образование солей в химических реакциях с металлами имеет широкое применение в различных сферах науки и промышленности. Это важный процесс в синтезе новых соединений, поэтому изучение химической реактивности металлов с солями является основополагающим при изучении химии и ее практических применений.
Реакции соляных кислот с металлами

Реакции соляных кислот с металлами являются одной из основных реакций в химии. Соляные кислоты обладают высокой активностью и способны активно взаимодействовать с большинством металлов. В процессе реакции между металлом и соляной кислотой происходит образование соли и выделение водорода.
Реакционная способность металлов взаимодействовать с соляными кислотами зависит от их электрохимического потенциала. Более активные металлы, такие как натрий, калий или цезий, образуют соли и выделяют водород даже при взаимодействии со слабыми соляными кислотами, такими как уксусная кислота. Более пассивные металлы, такие как алюминий, железо или цинк, могут реагировать только с более концентрированными соляными кислотами, например, соляной кислотой.
Реакция соляных кислот с металлами может проходить мгновенно или несколько медленней. Например, реакция цинка с соляной кислотой происходит очень быстро, с выделением интенсивного шипящего звука и пузырьков водорода. А реакция железа с соляной кислотой происходит медленней - вначале образуется растворимая соль, а затем выделяется водород.
Реакции соляных кислот с металлами используются в различных сферах науки и техники. Например, в процессе гальванической обработки металлов, при которой происходит удаление окислов и накипи, используется раствор соляной кислоты. Также реакции металлов с соляными кислотами используются в процессе получения солей, которые широко применяются в разных отраслях промышленности.
Уравнения реакций металлов с солями

Химическое взаимодействие металлов с солями является одной из основных реакций, которые происходят в химии. Металлы проявляют различную активность в отношении солей, что приводит к разнообразию уравнений реакций.
При реакции металлов с солями обычно происходит обмен ионами. Металл переходит из своей нейтральной формы в форму положительно заряженного иона, а ион соли, соответственно, меняет свою зарядность.
Примером такой реакции является взаимодействие цинка с солями меди. Цинк, будучи более активным металлом, замещает медь в соли и образует свою соль, а медь переходит в ионное состояние и выделяется в виде осадка. Уравнение реакции:
Zn + CuSO4 → ZnSO4 + Cu
Также известна реакция свинца с солями серебра. Свинец, также более активный металл, вытесняет серебро из его соли и образует свою соль, а серебро выпадает в виде осадка. Уравнение реакции:
Pb + 2AgNO3 → Pb(NO3)2 + 2Ag
Таким образом, уравнения реакций металлов с солями представляют собой основу для понимания и изучения принципов химического взаимодействия различных веществ.
Факторы, влияющие на скорость реакции металлов с солями

Скорость реакции металлов с солями зависит от нескольких факторов, включая:
- Вид металла. Реактивность металла и его склонность к окислению играют важную роль в определении скорости реакции. Некоторые металлы, такие как активные щелочные металлы, реагируют быстро и энергично с солями, в то время как менее активные металлы могут иметь медленную скорость реакции.
- Концентрация соли. Более высокая концентрация соли обычно способствует более быстрой реакции с металлом. Это связано с тем, что большее количество реагента приводит к большему количеству столкновений между солями и металлом, что увеличивает вероятность успешной реакции.
- Температура. Повышение температуры может увеличить скорость реакции металлов с солями. При повышении температуры частицы металла и соли обладают большей кинетической энергией, что способствует более частым и энергичным столкновениям и, соответственно, ускоряет реакцию.
- Площадь поверхности металла. Увеличение площади поверхности металла, например, путем измельчения или деления его на мельчайшие частицы, может значительно увеличить скорость реакции. Большая площадь поверхности обеспечивает большее количество активных мест, где металл может реагировать с солями.
Изучение этих факторов позволяет более полно понять и контролировать скорость реакции металлов с солями. Знание данных факторов может быть полезным для оптимизации процессов химических реакций, а также для разработки новых материалов и технологий.
Важность изучения химического взаимодействия металлов с солями

Химическое взаимодействие металлов с солями является одним из основных принципов химии и имеет огромное значение в различных областях науки и промышленности. Изучение этого процесса позволяет понять механизмы реакций, определить свойства солей и металлов, а также разработать новые материалы с улучшенными характеристиками.
Взаимодействие металлов с солями играет особую роль в химическом анализе. Оно позволяет определять наличие и концентрацию различных веществ, осуществлять качественный и количественный анализ образцов. При этом взаимодействие металлов с ионами в солях происходит по определенным закономерностям, что облегчает и усиливает процесс анализа.
Кроме того, изучение химического взаимодействия металлов с солями находит применение в металлургии. Знание об этом процессе позволяет контролировать реакции окисления и коррозии металлов, что существенно влияет на их долговечность и стабильность. Также изучение реакций металлов с солями позволяет разрабатывать новые способы и методы обработки, снижая затраты на производство и улучшая качество конечного продукта.
Важность изучения химического взаимодействия металлов с солями проявляется и в области медицины и фармацевтики. Изучение данной темы помогает разрабатывать новые препараты и лекарства на основе металлов, а также оптимизировать их действие в организме. Кроме того, металлы с солями часто используются в лечебных процедурах, например, при физиотерапии или хелатной терапии.
Таким образом, изучение химического взаимодействия металлов с солями имеет большую важность в различных областях науки и промышленности. Оно позволяет расширить наши знания о свойствах металлов и солей, улучшить методы анализа и производства, а также создать новые материалы и лекарства с улучшенными характеристиками и эффективностью.
Вопрос-ответ

Что такое химическое взаимодействие металлов с солями?
Химическое взаимодействие металлов с солями - это процесс, когда металл вступает в реакцию с солью и образует новые вещества. В ходе этой реакции происходит обмен ионами между металлом и солью, что приводит к образованию осадков или выпадению газа.
Какие принципы лежат в основе химического взаимодействия металлов с солями?
Основными принципами химического взаимодействия металлов с солями являются электронный обмен и обмен ионами. Металл отдает электроны, образуя положительный ион, а соль получает электроны и образует отрицательный ион. Эти ионы могут притягиваться к друг другу и образовывать осадок или растворяться в воде.
Какие реакции могут происходить при взаимодействии металлов с солями?
При взаимодействии металлов с солями могут происходить различные реакции, такие как образование осадков, растворение солей и образование газов. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водород. При взаимодействии алюминия с хлоридом калия образуется алюминий-хлорид и хлорид калия. Эти реакции широко используются в химической промышленности и в лабораторных условиях.
