Химические реакции, происходящие между азотом и металлами, представляют собой весьма интересное и важное явление в области химии. Азот и металлы обладают различными свойствами и энергетическими характеристиками, что определяет тип и ход данных реакций. Взаимодействие азота с металлами может иметь как спонтанный характер, так и происходить под воздействием определенных условий, например, при пониженной температуре или в присутствии катализаторов.
Одной из наиболее известных реакций азота с металлами является образование азидов. Азиды представляют собой соли азотистоводородной кислоты, их основным компонентом является азот. Данная реакция может протекать с различными металлами, такими как натрий, калий, свинец и др. Образование азидов происходит при взаимодействии азота с металлом, что приводит к выделению азотного газа и образованию соответствующего металлического соединения.
Еще одной важной и интересной реакцией азота с металлами является образование нитридов. Нитриды представляют собой соединения металлов с азотом, которые обладают своеобразными свойствами и применяются в различных областях, таких как материаловедение и электроника. Образование нитридов может происходить как при прямом взаимодействии азота с металлом, так и в результате термической обработки соответствующего соединения.
Химическое уравнение реакции азота с металлами является математическим выражением процесса взаимодействия азота и металла, которое отражает начальные и конечные состояния данных компонентов и их преобразования. Это уравнение позволяет описать и объяснить результаты реакции, а также определить необходимые условия для ее осуществления.
Химическое уравнение
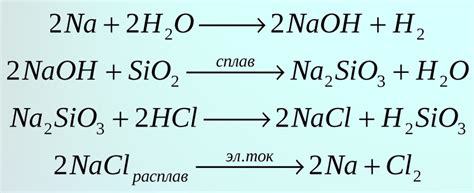
Химическое уравнение является основным инструментом в химии для представления химических реакций. Оно позволяет описать реагенты, продукты и условия реакции. Химические уравнения состоят из химических формул и коэффициентов.
Химические формулы представляют собой комбинацию символов элементов, которые указывают, какие атомы участвуют в реакции. Коэффициенты обозначают количество молекул или атомов каждого реагента и продукта, участвующих в реакции. Они используются для балансировки уравнения.
Химическое уравнение реакции азота с металлами может иметь вид:
- 2N2 + 3Cu → 3CuN2
- 2N2 + 2Ni → 2NiN
- N2 + 3Fe → Fe3N2
Эти уравнения показывают, что две молекулы азота реагируют с определенным количеством металлов, образуя соединения между ними. В результате образуются продукты реакции, которые также указаны в уравнении.
Химические уравнения позволяют предсказать атому при химических реакциях, а также использовать их для решения различных химических задач, таких как определение коэффициентов реакций или расчеты количества продуктов реакции.
Реакция азота

Реакция азота с металлами – это процесс взаимодействия азота с различными металлическими элементами. Азот, обладающий высокой химической активностью, способен образовывать различные соединения с металлами. Это позволяет использовать азотные соединения для различных промышленных и научных целей.
При реакции азота с металлами обычно образуются азиды, которые представляют собой соли азотистоводородной кислоты (HN3). Азиды характеризуются высокой нестабильностью и взрывоопасностью, поэтому их использование требует особой осторожности. Однако, несмотря на свою определенную опасность, азиды находят применение в различных областях, включая фармацевтику, пиротехнику и сельское хозяйство.
Реакция азота с металлами имеет большое практическое значение. Например, азотные соединения используются в производстве удобрений – одной из главных задач аграрной науки. Также эти соедине
Взаимодействие азота с металлами
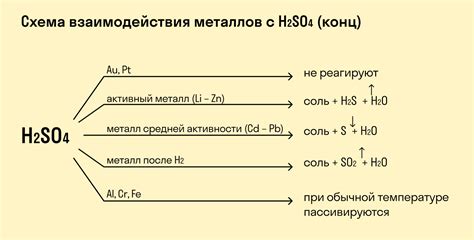
Азот, химический элемент с номером 7, интересен взаимодействием с металлами. При контакте с некоторыми металлами, азот может образовывать различные соединения. Это взаимодействие может протекать как в обычных условиях, так и при повышенной температуре и давлении.
Одним из наиболее известных соединений азота с металлами является азотид. Азотиды представляют собой соли азотистой кислоты, образуемые при реакции азота с металлами. В зависимости от металла, с которым взаимодействует азот, азотиды могут иметь разные свойства и применения.
Некоторые металлы, такие как литий, натрий и калий, хорошо реагируют с азотом и образуют азотиды. Эти соединения обладают высокой степенью реактивности и могут быть использованы в качестве катализаторов, взрывчатых веществ или удобрений.
В то же время, некоторые металлы, например, железо и алюминий, не реагируют легко с азотом. Однако, при определенных условиях, таких как высокая температура или электрический разряд, эти металлы все же могут образовывать соединения с азотом, например, нитриды. Нитриды обладают высокой твердостью и могут быть использованы в производстве резистентных материалов.
Взаимодействие азота с металлами является предметом исследования в области химии. Ученые постоянно открывают новые соединения и изучают их свойства и возможности применения в различных областях жизни, от промышленности до медицины.
Термическое разложение

Термическое разложение – это процесс реакции, при которой вещество распадается на более простые компоненты под воздействием высокой температуры. Этот процесс возможен для разных типов веществ, в том числе для соединений азота и металлов.
При термическом разложении соединений азота с металлами происходит разложение азота на нитроген (N2) и металлические оксиды. Реакция может протекать в различных условиях: при нагревании в печи, при горении или при наличии катализатора. Термическое разложение может быть экзотермическим – с выделением тепла, или эндотермическим – с поглощением тепла.
Примером реакции термического разложения является разложение азида натрия (NaN3). При нагревании азида натрия до 300°C происходит разложение на металлический натрий (Na) и азот (N2). Эта реакция широко используется в автомобильных подушках безопасности, где азида натрия служит источником азота, необходимого для быстрого наполнения подушки в случае аварии.
Термическое разложение соединений азота с металлами имеет широкие применения в промышленности и науке. К этому процессу относится также разложение азота на металлы при высоких температурах в плазменных установках, что позволяет получать различные металлические материалы и компоненты для электроники и других отраслей промышленности.
Образование соединений

Образование соединений - это процесс, при котором различные элементы или соединения соединяются между собой, образуя новые вещества. В химии это происходит путем химических реакций, которые могут быть представлены в виде химических уравнений.
В химическом уравнении реакции азота с металлами показывается, как атомы азота соединяются с атомами металла, образуя новые соединения. В зависимости от металла и условий реакции могут образовываться различные соединения. Например, при взаимодействии азота с железом может образоваться азотид железа (Fe3N2).
Образование соединений может быть результатом различных типов химических реакций. Например, реакция металла с кислородом может привести к образованию оксида металла. Азот с металлом может соединяться через образование нитридов. Кроме того, образование соединений может происходить путем обменной реакции, когда одни ионы замещают другие в реагентах.
Образование соединений играет важную роль в различных процессах и технологиях. Например, в области материаловедения образование сплавов является основным методом получения новых материалов с улучшенными свойствами. Также образование соединений имеет применение в производстве удобрений, катализаторов, лекарственных средств и многих других областях науки и промышленности.
Окисление и восстановление
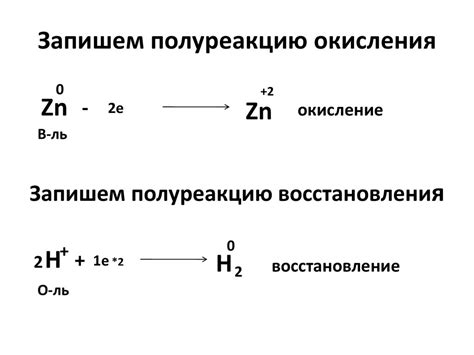
Окисление и восстановление – это одни из основных химических процессов, происходящих во многих реакциях. Окисление означает потерю электронов, а восстановление – приобретение электронов.
В реакциях окисления-восстановления можно выделить два ключевых понятия: окислитель и восстановитель. Окислитель – это вещество, которое принимает электроны и при этом само восстанавливается. Восстановитель – это вещество, которое отдает электроны и при этом само окисляется.
Процессы окисления и восстановления имеют большое значение в химии и применяются в разных областях. Например, в электрохимии, окислительно-восстановительные реакции используются для создания электрической энергии. Также эти процессы применяются в аналитической химии для определения содержания определенных веществ в образцах.
В реакциях азота с металлами, окисление и восстановление играют важную роль. Например, при окислении азота металлом, азот окисляется снижением валентности, тогда как металл восстанавливается. Это позволяет получить соединения азота с металлами.
Применение в промышленности

Химическое уравнение реакции азота с металлами является основой для многих промышленных процессов. Одним из таких процессов является азотирование металлов, которое используется для улучшения их свойств. Реакция азота с металлами может происходить при высоких температурах или в присутствии катализаторов.
Промышленное применение реакции азота с металлами широко распространено в производстве нитридных покрытий. Нитридные покрытия обладают высокой твердостью, износостойкостью и химической стойкостью, что делает их идеальным выбором для защиты поверхностей металлических изделий.
Реакция азота с металлами также используется в процессе азотирования стали. При азотировании стальной заготовки атомы азота проникают в поверхность металла, образуя твердые растворы с металлической матрицей. Это повышает твердость и стойкость к износу стали, делая ее идеальной для производства инструментов и деталей, которые подвергаются сильным механическим нагрузкам.
Кроме того, реакция азота с металлами используется в процессе производства аммиака. Аммиак широко применяется в различных отраслях промышленности, включая производство удобрений, пластмасс и взрывчатых веществ. Процесс производства аммиака основан на каталитической реакции между азотом и водородом, которая происходит на поверхности металлического катализатора.
Вопрос-ответ

Что происходит при реакции азота с металлами?
При реакции азота с металлами происходит образование нитридов металлов.
Какое химическое уравнение описывает реакцию азота с металлами?
Обычно химическое уравнение реакции азота с металлами имеет вид: N2 + 3M → 2MN, где N2 - молекула азота, M - металл, MN - нитрид металла.
Какие металлы могут реагировать с азотом?
С азотом могут реагировать многие металлы, такие как литий, магний, алюминий, бериллий, титан, цирконий, ванадий, марганец, железо, никель, кобальт, рутений, родий, и др.
Какие свойства нитридов металлов?
Нитриды металлов обладают высокой термической и химической стабильностью, имеют высокую твердость и плавятся при высоких температурах. Они также могут иметь полупроводниковые свойства и применяются в различных индустриальных процессах.
Для чего используют нитриды металлов?
Нитриды металлов имеют широкий спектр применений. Они используются в производстве электронных компонентов, катализаторов, покрытий для защиты от коррозии, инструментов с повышенной твердостью, а также в других областях промышленности и науки.
