Щелочные металлы являются одной из основных групп элементов в периодической системе. Они характеризуются наличием одной электронной оболочки и имеют очень низкую энергию ионизации, что делает их очень реактивными. Химический знак щелочного металла является важным инструментом для обозначения этих элементов.
Щелочные металлы обладают рядом уникальных свойств и химических реакций. Они очень реактивны и легко вступают во взаимодействие с кислородом, водой и другими веществами. Они также обладают способностью образовывать сильные основания, такие как щелочи, что позволяет им использоваться в различных химических процессах.
Одно из наиболее широко используемых приложений щелочных металлов состоит в производстве щелочных батарей. Эти батареи имеют высокую плотность энергии и используются в различных электронных устройствах, таких как мобильные телефоны, планшеты и ноутбуки. Кроме того, щелочные металлы используются в производстве сплавов, стекол, лекарственных препаратов и многих других продуктах.
Определение и значение щелочных металлов
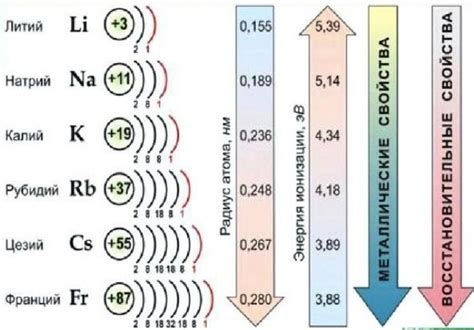
Щелочные металлы - это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы элементов и характеризуются высокой реактивностью и химической активностью.
Щелочные металлы обладают рядом уникальных свойств, которые делают их важными в различных областях научных и промышленных приложений. Они химически реактивны, легко претерпевают окисление и быстро реагируют с водой, кислородом и другими веществами.
Важное значение щелочных металлов обусловлено их широким спектром применений. Например, натрий используется в производстве стекла, щелочных батарей, а также в пищевой промышленности в качестве пищевого добавки. Калий является необходимым макроэлементом для растений и используется в сельском хозяйстве в качестве удобрения. Литий применяется в аккумуляторах, аслитии и других технологиях. Кроме того, щелочные металлы используются в ядерной энергетике, металлургии и других отраслях промышленности.
Таким образом, щелочные металлы играют важную роль в современной науке и промышленности. Их уникальные свойства и широкий спектр применений делают их неотъемлемой частью нашей жизни.
Физические и химические свойства щелочных металлов
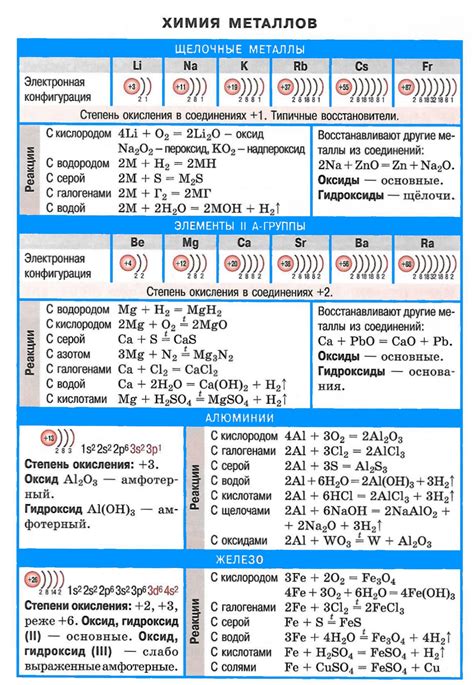
Щелочные металлы – это элементы первой группы периодической таблицы. Они включают литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают рядом химических и физических свойств, которые делают их уникальными и применимыми в различных областях. Например, щелочные металлы хорошо растворяются в воде и обладают высокой электропроводностью.
Один из основных физических параметров щелочных металлов – это их низкое плотность. Ниже лития все щелочные металлы имеют относительно низкую плотность, что делает их легкими и малоупругими материалами. Кроме того, щелочные металлы имеют низкую температуру плавления и кипения, что обусловлено малым количеством энергии, необходимым для разрушения их межатомных связей.
Химические свойства щелочных металлов также являются интересными и значимыми. Они очень активно реагируют с водой, образуя щелочные растворы и выделяя водородный газ. Эта реакция сопровождается значительным выделением тепла, что позволяет использовать щелочные металлы в различных термохимических процессах. Кроме того, щелочные металлы обладают способностью образовывать стабильные оксиды и гидриды.
- Литий, например, используется в производстве литий-ионных аккумуляторов и ядерных реакторов.
- Натрий широко применяется в пищевой промышленности, балластных системах и производстве стекла.
- Калий используется в сельском хозяйстве как удобрение, а также в производстве батарей, стекла и мыла.
- Рубидий используется в научных исследованиях, в производстве лазеров и атомных часов.
- Цезий имеет применение в электронике, медицине и ядерных технологиях.
- Франций, самый редкий и радиоактивный щелочный металл, применяется в научных исследованиях и радиоактивной терапии.
Выводящая таблица характеристик щелочных металлов:
| Элемент | Атомный номер | Относительная атомная масса | Температура плавления (°C) | Температура кипения (°C) |
|---|---|---|---|---|
| Литий | 3 | 6.94 | 180.5 | 1347 |
| Натрий | 11 | 22.99 | 97.72 | 892.9 |
| Калий | 19 | 39.10 | 63.38 | 758.8 |
| Рубидий | 37 | 85.47 | 38.89 | 688 |
| Цезий | 55 | 132.91 | 28.44 | 671 |
| Франций | 87 | 223 | 27 | 677 |
Применение щелочных металлов в различных отраслях

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в различных отраслях человеческой деятельности.
1. Химическая промышленность:
Щелочные металлы широко используются в производстве различных химических веществ. Например, натрий используется для производства мыла, отбеливателей и стекла. Калий применяется при производстве удобрений. Литий используется в производстве аккумуляторов и лекарств.
2. Металлургическая промышленность:
Щелочные металлы являются необходимыми компонентами при производстве различных металлов. Например, натрий используется для получения алюминия методом электролиза. Кроме того, калий применяется для производства сплавов и легирования металлов.
3. Энергетика:
В энергетике щелочные металлы используются в батареях. Литий-ионные аккумуляторы на основе лития позволяют получить высокую энергетическую плотность и являются основными аккумуляторами для мобильных устройств и электромобилей.
4. Ядерная энергетика:
В ядерной энергетике рубидий и цезий используются в качестве источников радиоактивного излучения для генерации электроэнергии. Они применяются в так называемых радиоизотопных термоэлектрических генераторах.
Таким образом, щелочные металлы играют важную роль в различных отраслях человеческой деятельности, от химической и металлургической промышленности до энергетики и ядерной энергетики.
Реакции щелочных металлов и их соединений
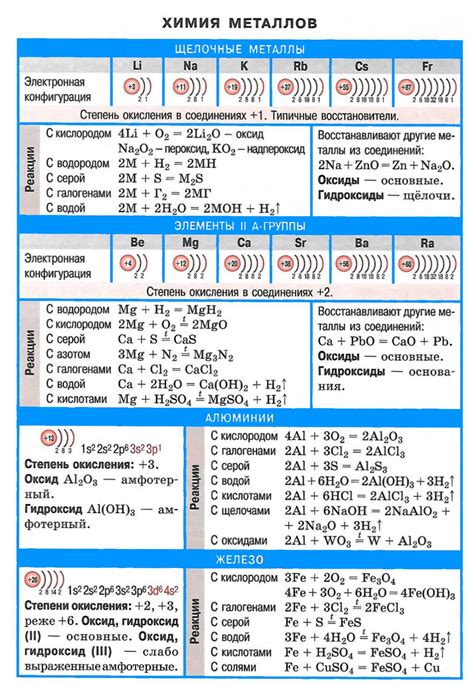
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют высокую реакционную активность из-за своей низкой ионизационной энергии. Они легко вступают в реакцию с водой, кислородом и неорганическими кислотами.
Реакция щелочных металлов с водой является наиболее известной. При контакте с водой щелочный металл образует щелочное гидроксидное соединение и выделяет водород. Например, натрий реагирует с водой, образуя гидроксид натрия и водород: 2Na + 2H2O → 2NaOH + H2.
Щелочные металлы также реагируют с кислородом. Например, литий горит в воздухе, образуя оксид лития: 4Li + O2 → 2Li2O. Кроме того, щелочные металлы реагируют с неорганическими кислотами, образуя соответствующие соли. Например, натрий реагирует с соляной кислотой, образуя хлорид натрия: 2Na + 2HCl → 2NaCl + H2.
Реакции щелочных металлов и их соединений имеют широкое применение в промышленности и лабораторной практике. Например, гидроксиды щелочных металлов используются в производстве мыла, стекла и щелочных аккумуляторов. Их соли широко применяются в пищевой, фармацевтической и химической промышленности.
Особенности использования щелочных металлов в экологических технологиях
Щелочные металлы, такие как литий, натрий и калий, широко применяются в экологических технологиях благодаря своим уникальным свойствам.
1. Энергетические системы: Литий-ионные аккумуляторы на основе лития широко используются в солнечных и ветровых энергетических системах. Они обладают высокой энергетической плотностью, что позволяет эффективно хранить и использовать возобновляемую энергию.
2. Экологическая очистка: Натрий и калий применяются в процессах очистки воды и воздуха. Натрий генерирует гипохлорит натрия, который является мощным дезинфицирующим средством и используется для очистки питьевой воды и бассейнов. Калий используется в системах очистки воздуха для поглощения и нейтрализации вредных веществ.
3. Солнечные батареи: Калиевые соединения используются в производстве солнечных батарей для создания прозрачной электродной пленки. Они обладают высокой проводимостью и стабильностью, что повышает эффективность солнечных батарей и улучшает их долговечность.
4. Водородные топливные элементы: Натрий и калий играют важную роль в производстве водородных топливных элементов. Они являются основными компонентами электролита и обеспечивают эффективную передачу протонов, что повышает эффективность работы топливной ячейки.
5. Медицинская техника: Литий используется в производстве биосовместимых материалов и электродов для имплантируемых устройств, таких как кардиостимуляторы. Он обладает высокой электропроводностью и химической инертностью, что делает его идеальным материалом для медицинских приложений.
Использование щелочных металлов в экологических технологиях позволяет эффективно решать проблемы экологического загрязнения и создавать устойчивые, чистые и энергоэффективные системы.
Вопрос-ответ

Какие свойства имеет щелочной металл?
Щелочные металлы обладают следующими свойствами: низкая плотность, низкая температура плавления, мягкость, высокая реактивность с водой и кислородом, хорошая электропроводность.
Каковы применения щелочных металлов в промышленности?
Щелочные металлы имеют широкое применение в промышленности. Например, натрий используется для производства щелочей, стекла, алюминия. Калий используется в производстве удобрений, стекла, мыла. Литий используется в производстве литий-ионных аккумуляторов, а также в медицине.
Почему щелочные металлы реагируют с водой?
Щелочные металлы реагируют с водой из-за того, что их электроотрицательность ниже, чем у водорода. В результате этой реакции образуется щелочное гидроксидное соединение и выделяется водород.
Каково значение щелочных металлов в живой природе?
Щелочные металлы имеют большое значение в живой природе. Например, натрий и калий являются необходимыми для правильного функционирования организма, они участвуют в нервно-мышечной активности и регулируют баланс воды в организме. Литий также используется в медицине для лечения психических расстройств, таких как биполярное расстройство.
