Радиус атома является важным характеристикой химического элемента. Он определяется расстоянием между ядром атома и его внешней электронной оболочкой. Чем больше радиус атома, тем больше места занимают его электроны в пространстве.
Металлы славятся большими радиусами атомов по сравнению с неметаллами и полуметаллами. Это объясняется особенностями строения их атомов. Металлический связь включает свободное движение электронов между атомами, что позволяет им занимать значительное пространство и увеличивать размер атома.
Среди металлов самый большой радиус атома имеет франций - самый тяжелый металл известный в нормальных условиях. Его атом имеет наибольшую зону расположения электронов и, следовательно, наибольший радиус. Франций представляет собой очень редкий элемент, относящийся к щелочным металлам и обладающий крайне высокой реактивностью.
Таким образом, франций имеет наибольший радиус атома из всех металлов. Знание радиусов атомов помогает углубить наши знания о строении химических элементов и их взаимодействии друг с другом.
Сравнение радиусов атомов металлов

Радиус атома является одним из важных физических характеристик элементов. Это расстояние от центра ядра до внешней границы электронной оболочки. В случае металлов, радиус атома может варьироваться в зависимости от конкретного элемента.
Металлы, как правило, имеют большой размер атомов по сравнению с неметаллами. Наибольший радиус атома обычно принадлежит алкалийным металлам, таким как литий, натрий, калий, рубидий и цезий. Это связано с тем, что алкалийные металлы имеют одну электронную оболочку и малое количество электронов в этой оболочке.
Некоторые другие металлы также имеют большие радиусы атомов. Например, серебро и золото имеют большие размеры, что делает их подходящими для использования в ювелирных изделиях. Алюминий, магний и кальций также имеют относительно большие радиусы атомов.
Однако стоит отметить, что радиус атома может изменяться в зависимости от различных факторов, включая химическую структуру и давление. Поэтому в конкретных условиях радиус атома металлов может быть различным.
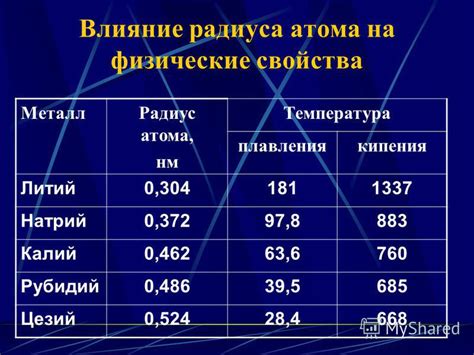
Выводящая таблица ниже показывает сравнительные значения радиусов атомов некоторых металлов:
| Металл | Радиус атома (нм) |
|---|---|
| Литий | 0,152 |
| Натрий | 0,186 |
| Калий | 0,231 |
| Алюминий | 0,143 |
| Магний | 0,160 |
| Кальций | 0,197 |
Таким образом, радиус атома металлов может быть различным и зависит от конкретного элемента. Наибольший радиус обычно принадлежит алкалийным металлам, но также есть другие металлы с большими размерами атомов.
Что такое радиус атома?
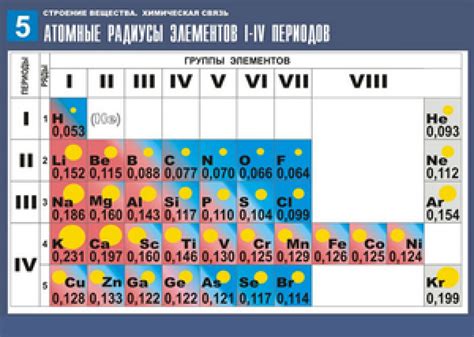
Радиус атома - это физическая величина, которая определяет размер атома элемента. Она показывает расстояние от центра ядра атома до его внешней электронной оболочки. Радиус атома является важным параметром, который влияет на его химические и физические свойства. Размер атома может варьироваться в зависимости от элемента и его электронной структуры.
Радиус атома описывается различными способами. Например, существуют ковалентные радиусы, ионные радиусы и металлические радиусы. Ковалентный радиус определяется как половина расстояния между ядрами двух одинаковых атомов, связанных между собой ковалентной связью. Ионный радиус, как следует из названия, относится к иону элемента и зависит от его заряда. Металлический радиус является характеристикой атома в металле и может быть больше, чем радиус атома того же элемента в не металлическом состоянии.
Радиус атома играет важную роль в химических реакциях и взаимодействиях между атомами. Например, размер атома влияет на вероятность столкновения атомов при реакции, а также на эффективность транспорта электрона между атомами. Большой радиус может способствовать образованию слабой связи, в то время как маленький радиус создает сильную связь.
Знание радиуса атомов элементов позволяет угадывать их свойства и химическое поведение. Например, элементы с большими радиусами склонны к образованию ионов с положительным зарядом, а элементы с маленькими радиусами чаще образуют ионы с отрицательным зарядом. Радиус атома является важным параметром в интерпретации и предсказании свойств химических элементов.
Значение радиуса атома для химических свойств

Радиус атома является одной из важных характеристик элементов и имеет значительное влияние на их химические свойства. Размер атома влияет на его способность участвовать в химических реакциях, связываться с другими атомами и образовывать молекулы.
Чем больше радиус атома, тем более распределены его электроны по области пространства. Это приводит к увеличению объема атома и уменьшению электростатической силы притяжения между ядром и электронами. Как результат, атом становится менее электроотрицательным и более склонным к донорству электронов.
Наибольший радиус атома обладают металлы, так как у них мало электронов в валентной оболочке и большое ядро. Межатомное расстояние в металлах больше, что делает их более подвижными и способными образовывать ионные связи с другими элементами.
Свойства металлов, такие как теплопроводность, электропроводность и пластичность, определяются их большими радиусами атомов. Большие радиусы облегчают движение электронов внутри металлической решетки и способствуют образованию свободных электронов.
Однако у каждого элемента есть свой характерный радиус атома, который зависит от его электронной конфигурации и расположения в периодической системе. Наибольший радиус атома у металлов находится в периоде 7, а наименьший - в периоде 1.
Как измеряют радиус атомов?
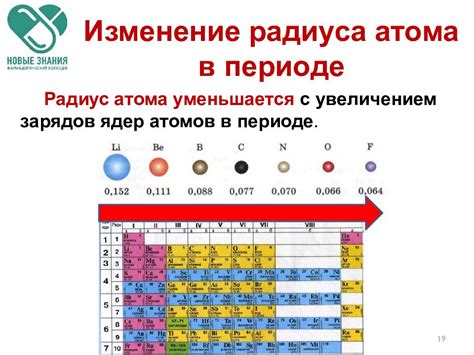
Измерение радиуса атомов - важная задача в химии и физике. Оно осуществляется с помощью различных методов и инструментов.
Один из самых распространенных методов - рентгеноструктурный анализ. Он основан на измерении углов дифракции рентгеновских лучей при их прохождении через кристалл. По этим данным рассчитывается пространственное расположение атомов в кристаллической структуре и определяется их радиус.
Другой метод - спектроскопия. Его основным принципом является измерение величины и формы спектральных линий, связанных с определенными переходами электронов в атоме. Из этих данных можно получить информацию о радиусе электронной оболочки атома, так как он напрямую связан с радиусом атома.
Также применяются методы, основанные на использовании различных микроскопов. Например, сканирующий туннельный микроскоп позволяет проследить поверхность атомов и измерить их диаметры.
Существуют и другие методы измерения радиуса атомов, такие как методы, основанные на изучении колебаний атомов или методы, основанные на измерении времени жизни радиоактивных изотопов. Комбинируя разные методы, ученые получают более точные и надежные данные о радиусе атомов различных элементов.
Измерение радиуса атомов имеет огромное значение для понимания химических и физических свойств веществ и процессов, в которых они участвуют. Эти данные помогают установить связи между структурой вещества и его свойствами, а также использовать эти знания в различных областях, таких как материаловедение, катализ, электроника и многое другое.
Какие металлы имеют большие радиусы атомов?
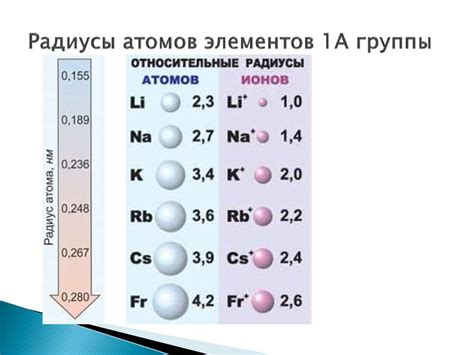
В периодической системе элементов существует множество металлов, которые имеют большие радиусы атомов. Радиус атома - это внутреннее расстояние от ядра атома до его наружной электронной оболочки. Такие металлы как калий, кальций и барий имеют наибольшие радиусы атомов в периоде, что делает их атомы более объемными и менее плотными.
Элементы можно также классифицировать по рядам. Внутри одного ряда радиус атомов обычно уменьшается от левого конца к правому. Однако, с ростом атомного номера, внутренняя электронная оболочка также растет, что приводит к увеличению радиуса атома. Металлы в середине периодической системы, такие как кобальт, никель и медь имеют радиусы атомов, большие по сравнению с другими элементами в том же периоде.
Другой способ классификации металлов с большими радиусами атомов - это классификация по группам. Некоторые металлы, такие как калий, рубидий и цезий, относятся к группе щелочных металлов. Щелочные металлы, как правило, имеют наибольшие радиусы атомов в своих группах. Это связано с тем, что атомы щелочных металлов имеют только одну электронную оболочку, что делает их атомы более объемными и менее плотными.
В целом, металлы с большими радиусами атомов обладают особыми химическими и физическими свойствами. Это делает их полезными в различных областях, таких как строительство, производство и технологии. Знание об атомных радиусах помогает ученым и инженерам лучше понять свойства и поведение различных металлов и использовать их в различных приложениях.
Самый большой радиус атома среди металлов
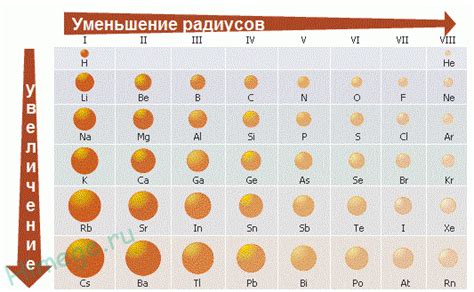
Радиус атома является одной из важных характеристик химического элемента. Он определяет размер и пространственное расположение электронных оболочек атома. В таблице элементов Менделеева можно наблюдать значительные различия в радиусах атомов разных элементов.
Среди всех металлов в таблице Менделеева самый большой радиус атома имеет цезий (Cs). Радиус атома цезия составляет около 265 пикометров (1 пикометр равен 10^-12 метра). Это является одним из самых больших радиусов среди всех элементов таблицы.
Большой радиус атома цезия связан с его электронной конфигурацией. У атома цезия 6 заполненных электронных оболочек, и он имеет всего лишь один внешний электрон. Это внешнее электронное облако слабо удерживается ядром и поэтому атом цезия имеет большой радиус.
Большой радиус атома цезия придает ему такие свойства, как мягкость, низкую температуру плавления и высокую реактивность. Он является одним из наиболее реактивных металлов и может взаимодействовать с водой, выделяя газ. Благодаря своим особенностям цезий находит применение в различных областях, включая научные исследования, производство электродов и некоторые медицинские процедуры.
Влияние радиуса атома на свойства металлов
Радиус атома – одно из ключевых свойств металлов, которое оказывает значительное влияние на их химические и физические свойства. Размер атома напрямую влияет на такие важные параметры, как плотность, теплопроводность, электропроводность и механическая прочность.
Чем больше радиус атома, тем меньше энергия, необходимая для его ионизации, и, соответственно, меньше температура плавления. Поэтому металлы с большим радиусом атомов, такие как калий и натрий, имеют низкую температуру плавления и являются хорошими проводниками электричества и тепла.
С другой стороны, металлы с меньшим радиусом атомов, такие как алюминий и цинк, обладают высокой твердостью и механической прочностью. Их атомы плотно упакованы в кристаллическую решетку, что делает эти металлы прочными и устойчивыми к деформации.
Размер атома также влияет на способность металла образовывать сплавы. Большие атомы имеют больше свободного места для встраивания атомов других элементов, поэтому металлы с большим радиусом атомов легче образуют сплавы, что делает их более пластичными и подверженными плавлению.
В целом, радиус атома является важным параметром, определяющим свойства металлов. Размер атома напрямую влияет на температуру плавления, твердость, механическую прочность и способность образовывать сплавы, делая его одним из факторов, которые необходимо учитывать при выборе металла для конкретных целей и приложений.
Какие факторы влияют на радиус атома металла?
Радиус атома металла является одним из важных параметров, который характеризует его размер. Этот параметр зависит от нескольких факторов:
- Элементарной структуры металла: Радиус атома металла зависит от типа его элементарной структуры. Большинство металлов обладают кристаллической структурой, в которой атомы металла упорядочены. Как правило, радиус атома металла определяется расстоянием между его ядром и областью, в которой вероятность найти электрон высока. Так, у металлов с кубической структурой, таких как железо и алюминий, радиус атома будет отличаться от радиуса металлов с гексагональной или спиральной структурой.
- Количество электронов: Радиус атома металла также связан с количеством электронов в его электронной оболочке. Чем больше атом имеет электронов, тем сильнее электронные облака отталкиваются друг от друга, что приводит к увеличению радиуса атома. Это объясняет, почему атомы металлов из периодической таблицы, находящиеся в более нижней группе, обычно имеют больший радиус.
- Заряд ядра: Чем больше заряд ядра металла, тем сильнее будет притяжение электронов и тем меньше будет радиус атома. Заряд ядра связан с числом протонов в ядре. Металлы, имеющие большее число протонов, обычно имеют меньший радиус атома.
Все эти факторы влияют на радиус атома металла и могут объяснить почему различные металлы имеют разные радиусы атомов.
Вопрос-ответ

Какой металл имеет наибольший радиус атома?
Металл, который имеет наибольший радиус атома, это франций (Fr). Радиус атома франция составляет около 260 пикометров.
Какой химический элемент имеет самый большой атомный радиус?
Самый большой атомный радиус имеет франций (Fr) - самый тугоплавкий и самый редкий либо таллий (Tl) - мягкий и пластичный металл.
У какого элемента наибольший атомный радиус?
Наибольший атомный радиус у элемента франция (Fr). Его атомный радиус составляет около 260 пикометров.
Какой металл обладает наибольшим атомным радиусом?
Металл с наибольшим атомным радиусом - это франций (Fr), его атомный радиус составляет около 260 пикометров.
