Щелочноземельные металлы являются элементами второй группы периодической таблицы. Эти металлы характеризуются химической активностью и способностью образовывать соединения с другими веществами. Химический процесс соединения щелочноземельных металлов позволяет получать разнообразные соединения, которые имеют широкое применение в различных областях науки и промышленности.
Соединения щелочноземельных металлов обладают рядом особенностей. Во-первых, они обычно обладают высокой степенью ионности. Это связано с тем, что атомы щелочноземельных металлов обладают малой электроотрицательностью и могут легко отдавать электрон. В результате образуется положительный ион, который образует с отрицательными ионами других элементов электростатическую связь. Во-вторых, соединения щелочноземельных металлов часто обладают высокой термической и химической стабильностью.
Соединения щелочноземельных металлов нашли применение во многих областях науки и промышленности. Например, оксид кальция (известный как известь) широко используется в строительной и медицинской промышленности. Карбонат магния (алмагель) применяется в фармацевтической промышленности для изготовления лекарственных препаратов. Кроме того, соединения щелочноземельных металлов используются в процессе производства стекла, керамики, а также в качестве катализаторов в химических реакциях.
Химический процесс соединения щелочноземельных металлов является важным направлением исследований в области химии. Ученые изучают принципы образования и свойства соединений этих металлов, а также разрабатывают новые методы получения и применения таких соединений. Знание химического процесса соединения щелочноземельных металлов позволяет не только расширить наши знания о мире элементов и соединений, но и найти новые способы их применения в различных сферах человеческой деятельности.
Соединение щелочноземельных металлов: химический процесс и его основные этапы

Соединение щелочноземельных металлов - это химический процесс, при котором происходит образование соединений между элементами второй группы периодической таблицы - бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra).
Основными этапами процесса соединения щелочноземельных металлов являются: получение металлического основания, получение целевого соединения и осуществление реакции с другими веществами.
- Получение металлического основания - осуществляется путем различных методов, таких как электролиз, фотохимические реакции или реакции взаимодействия с другими металлами.
- Получение целевого соединения - в этом этапе металлическое основание соединяется с другими химическими элементами или соединениями, образуя новые соединения щелочноземельных металлов. Это может быть оксид, гидроксид, карбонат, нитрат и другие соединения.
- Реакция с другими веществами - после получения целевого соединения, оно может использоваться в различных химических реакциях и превращаться в другие вещества. Иногда соединения щелочноземельных металлов являются хорошими катализаторами в химических процессах.
Соединение щелочноземельных металлов широко используется в различных отраслях промышленности, таких как производство стекла, литейные процессы, производство аккумуляторов и т.д. Кроме того, щелочноземельные металлы являются важными элементами в биохимии и медицине, играя роль в регуляции физиологических процессов и в различных терапевтических приложениях.
Щелочноземельные металлы: основные характеристики и свойства

Щелочноземельные металлы – это группа элементов в периодической системе, которая включает бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они располагаются во второй группе периодической таблицы и характеризуются рядом общих свойств.
Первое основное свойство – высокая реактивность щелочноземельных металлов. Они активно взаимодействуют с водой, кислородом и многими другими веществами. Такая реактивность вызвана их низкой ионизационной энергией, что способствует легкому отдаче внешнего электрона.
Второе основное свойство – низкий плавления щелочноземельных металлов. Они плавятся при низких температурах и образуют мягкие металлические материалы. Например, магний плавится при температуре около 650 °С, а барий – около 725 °С.
Третье основное свойство – хорошая электропроводность щелочноземельных металлов. Они обладают металлическим блеском и легко проводят электрический ток. Это связано с наличием свободных электронов в их кристаллической решетке.
Четвертое основное свойство – способность образовывать соли. Щелочноземельные металлы образуют разнообразные химические соединения, включая оксиды, гидроксиды, хлориды и другие. Эти соединения широко используются в промышленности и науке.
В целом, щелочноземельные металлы обладают уникальным набором химических и физических свойств, которые делают их важными элементами для различных областей человеческой деятельности.
Важность соединения щелочноземельных металлов в химических процессах

Соединения щелочноземельных металлов играют важную роль во многих химических процессах. Они обладают рядом уникальных свойств, которые находят применение в различных отраслях промышленности и науки.
Одним из наиболее известных соединений щелочноземельных металлов является гидроксид кальция (известь). Он широко используется в строительстве для производства цемента, изготовления железобетона и др. Гидроксид кальция также применяется в сельском хозяйстве для улучшения качества почвы и регулирования кислотности.
Еще одним важным соединением щелочноземельных металлов является оксид магния (магнезия). Он используется в производстве огнеупорных материалов, стекла, электродов, фармацевтики и др. Магнезия также применяют в металлургической промышленности для получения магниевых сплавов.
Карбиды щелочноземельных металлов, такие как карбид кальция, имеют широкое применение в электротехнике, сварке, производстве кальция цианида. Карбиды служат источником ацетиленовой сварочной газовой смеси и используются в качестве каталитических промежуточных продуктов.
Соединения щелочноземельных металлов также находят использование в производстве батарей, пленок для солнечных батарей, лазерных и оптических материалов, а также в медицине для создания лекарственных препаратов и протезов.
В целом, соединения щелочноземельных металлов играют важную роль в современных химических процессах. Они имеют широкий спектр применения и вносят значительный вклад в развитие технологий в различных областях промышленности и науки.
Формирование ионов щелочноземельных металлов: механизм и условия
Формирование ионов щелочноземельных металлов происходит в результате различных химических процессов, которые зависят от условий и реагентов, участвующих в реакции. Одним из основных механизмов образования ионов щелочноземельных металлов является их реакция с кислотами.
При взаимодействии щелочноземельных металлов с кислотами происходит обмен протонов, что приводит к образованию соответствующих солей. Например, реакция между щелочноземельным металлом магнием и серной кислотой приводит к образованию сульфата магния и выделению молекулы воды:
Магний + серная кислота → сульфат магния + вода
Для осуществления этого процесса необходимо наличие свободных ионов металла и кислоты, а также определенных условий, например, оптимальной температуры и концентрации реагентов. Также важной ролью в образовании ионов щелочноземельных металлов играют электроны, которые участвуют в реакционных превращениях и помогают осуществить перенос зарядов.
Однако щелочноземельные металлы могут образовывать ионы не только при реакции с кислотами, но и в других химических процессах. Например, при взаимодействии с веществами, содержащими активные группы, такие как оксиды, гидроксиды, или аминокислоты, протекают реакции, в результате которых образуются ионы соответствующего металла.
Таким образом, формирование ионов щелочноземельных металлов зависит от ряда факторов и условий, включая химический состав реагентов, их концентрацию и температуру, а также наличие активных групп или присутствие других веществ, способствующих различным реакциям. Изучение этих процессов важно для понимания механизмов химических реакций и их применения в различных областях науки и техники.
Реакция соединения щелочноземельных металлов с кислотами

Щелочноземельные металлы - это элементы, расположенные во второй группе таблицы Менделеева. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Реакция этих металлов с кислотами является характерной особенностью их химического поведения.
Кислоты - это химические соединения, которые обладают кислотными свойствами и могут отдавать протоны. Некоторые из наиболее распространенных кислот включают серную кислоту (H2SO4), соляную кислоту (HCl) и азотную кислоту (HNO3).
При взаимодействии щелочноземельных металлов с кислотами происходит реакция, в результате которой образуются соли и выделяются соответствующие газы. Например, при взаимодействии металлов бериллия, магния, кальция и стронция с серной кислотой образуются сульфаты металлов и выделяется водород. Реакция можно представить следующим образом:
Be + H2SO4 → BeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
Ca + H2SO4 → CaSO4 + H2
Sr + H2SO4 → SrSO4 + H2
Также, при реакции щелочноземельных металлов с соляной кислотой, образуются хлориды металлов и выделяется водород:
Mg + 2HCl → MgCl2 + H2
Ca + 2HCl → CaCl2 + H2
Sr + 2HCl → SrCl2 + H2
Ba + 2HCl → BaCl2 + H2
Эти реакции являются экзотермическими и сопровождаются выделением тепла. Они позволяют использовать щелочноземельные металлы для нейтрализации кислых растворов и получения солей, которые могут иметь широкий спектр применения в различных отраслях промышленности и научных исследований.
Химический процесс образования соединений щелочноземельных металлов с оксидами

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, обладают высокой химической активностью и реактивностью при взаимодействии с оксидами. Химический процесс образования соединений щелочноземельных металлов с оксидами осуществляется путем реакции между металлом и кислородом, который является основным компонентом оксидов.
Данный процесс осуществляется при высоких температурах, когда ионы металла и ионы кислорода взаимодействуют, образуя ионную связь и образуя новое соединение. В результате этой реакции происходит окисление щелочноземельного металла и образование стабильного соединения, содержащего ион металла и ион кислорода.
Образование соединений щелочноземельных металлов с оксидами можно проследить по реакционным схемам. Например, магний может реагировать с оксидом кислорода (O2) при нагревании, образуя оксид магния (MgO):
- Магний (Mg) + Кислородный газ (O2) → Оксид магния (MgO)
Аналогичным образом происходит взаимодействие кальция, стронция и бария с оксидами, образование соединений которых можно представить следующими реакциями:
- Кальций (Ca) + Кислородный газ (O2) → Оксид кальция (CaO)
- Стронций (Sr) + Кислородный газ (O2) → Оксид стронция (SrO)
- Барий (Ba) + Кислородный газ (O2) → Оксид бария (BaO)
Образованные оксиды могут быть использованы в различных отраслях промышленности, например, в производстве стекла, керамики и катализаторов. Знание этого химического процесса является важным для разработки новых материалов и применений щелочноземельных металлов.
Взаимодействие щелочноземельных металлов с водой: образование гидроксидов и выделение водорода
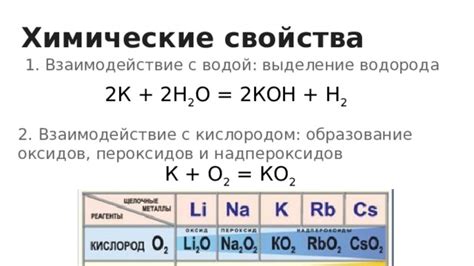
Взаимодействие щелочноземельных металлов с водой является химическим процессом, в результате которого образуются гидроксиды и выделяется водород. Щелочноземельные металлы, такие как магний, кальций, стронций и барий, обладают высокой реакционной способностью при контакте с водой.
В процессе взаимодействия металла с водой происходит окисление металла и одновременное восстановление воды. Металлический металл отдает свои электроны молекулам воды, образуя гидроксид металла и выделяясь водород. Реакция обычно происходит достаточно быстро и сопровождается выделением пузырьков водорода.
Гидроксиды щелочноземельных металлов являются основными веществами, обладающими высокой щелочностью. Они способны образовывать водородные ионы (H+) в водном растворе, что делает их хорошими щелочными реагентами. Гидроксиды этих металлов широко используются в различных отраслях промышленности и научных исследованиях.
Взаимодействие щелочноземельных металлов с водой имеет также практическое применение. Например, в реактивных двигателях жидкостных ракет гидроксиды щелочноземельных металлов используются в качестве окислителей, обеспечивая высокую температуру сгорания и эффективный тяговый эффект.
Соединение щелочноземельных металлов и галогенов: реакция образования солей

Щелочноземельные металлы и галогены могут образовывать стабильные соединения, называемые солями. Эти соединения обладают высокой степенью электроотрицательности и обусловлены химической реакцией обмена ионами между металлом и неметаллом.
В процессе образования солей между щелочноземельным металлом и галогеном происходит передача электронов. Галоген (например, хлор) забирает электроны от щелочноземельного металла (например, магния), образуя отрицательно заряженный анион. В свою очередь, металл отдает эти электроны и становится положительно заряженным катионом.
Образовавшиеся ионы металла и галогена притягиваются друг к другу электростатическими силами и образуют кристаллическую структуру, которая является солью. Такие соли обычно имеют высокие плавления и являются хрупкими и твердыми веществами.
Реакция образования солей между щелочноземельными металлами и галогенами может быть представлена уравнением реакции:
- М(галоген) + X(щелочноземельный металл) → MX(соль),
где М - галоген (например, хлор или бром), X - щелочноземельный металл (например, магний или кальций), MX - соль.
Эта реакция имеет большое промышленное и практическое значение. Соли щелочноземельных металлов и галогенов используются в различных отраслях промышленности, а также в процессе производства лекарственных препаратов и других химических соединений.
Использование соединений щелочноземельных металлов в различных отраслях промышленности

Соединения щелочноземельных металлов (магний, кальций, стронций, барий и радий) широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам и химическим реакциям.
Одно из основных применений соединений щелочноземельных металлов - производство легких сплавов и металлических конструкций. Магний и его сплавы обладают низкой плотностью, хорошей коррозионной стойкостью и высокой прочностью на растяжение, поэтому они широко используются в авиационной и автомобильной промышленности для создания легких и прочных деталей.
Кальций и его соединения являются неотъемлемой частью сельскохозяйственной отрасли. Кальций содержится в многих удобрениях и используется для улучшения качества почвы и повышения урожайности. Кроме того, кальций активно используется в производстве молочных продуктов и пищевых добавок.
Стронций и его соединения, благодаря своим фосфоресцирующим свойствам, нашли применение в производстве световых элементов и ламп. Стронциевые компоненты добавляют в светоизлучающие материалы, что позволяет создавать яркий и долговечный свет. Кроме того, стронций используется при производстве радиорелейных антенн и электродных материалов.
Барий и его соли нашли широкое применение в медицине. Бариевые соединения используются в качестве контрастных веществ для рентгенологических исследований пищевода, желудка, кишечника и других органов. Кроме того, барий используется для производства стекла, керамики и пластмасс, а также в нефтяной и газовой промышленности в качестве мудинг-агента.
Радий, являющийся радиоактивным щелочно-земельным металлом, находит применение в ядерной промышленности и научных исследованиях. Изотопы радия используются в качестве источников ионизирующего излучения для радиотерапии и радиоизотопных методов диагностики. Кроме того, радий применяется в качестве светящихся элементов в научных исследованиях и при производстве жидких счетчиков и детекторов излучения.
Вопрос-ответ

Что такое щелочноземельные металлы?
Щелочноземельные металлы - это элементы, которые относятся к 2-й группе периодической таблицы Менделеева. В эту группу входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они отличаются отщелочных металлов тем, что менее реактивны, но все же обладают щелочными свойствами.
Какие химические процессы могут происходить со щелочноземельными металлами?
Со щелочноземельными металлами могут происходить различные химические процессы. Например, они могут реагировать с водой, кислородом, кислотами и другими веществами. Также щелочноземельные металлы могут образовывать соединения с другими элементами или соединения между собой.
Что происходит при соединении щелочноземельных металлов?
При соединении щелочноземельных металлов происходит образование ионов металла с положительным зарядом и анионов других элементов с отрицательным зарядом. Например, при реакции кальция с кислородом образуется ион кальция Ca2+ и ион кислорода O2-. Такие ионы образуют кристаллическую решетку соединения.
В каких областях используются соединения щелочноземельных металлов?
Соединения щелочноземельных металлов имеют широкое применение в различных областях. Например, оксиды и гидроксиды щелочноземельных металлов используются в производстве стекла и керамики, а также в производстве щелочей. Сульфаты и карбонаты щелочноземельных металлов используются в качестве удобрений. Также соединения щелочноземельных металлов используются в медицине, электронике и других отраслях.
