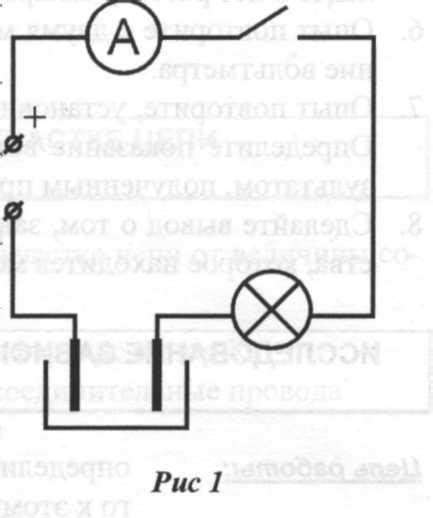
Химический источник электрического тока – это устройство, которое может преобразовывать химическую энергию в электрическую. Одним из принципов работы таких источников является взаимодействие металлов или их оксидов, что позволяет создать разницу в электродных потенциалах и запустить поток электрического тока.
В основе химических источников электрического тока лежит реакция окисления и восстановления металлов или их оксидов. Для этого необходимо наличие двух электродов, каждый из которых состоит из разного материала. Один из электродов (анод) вступает в окислительную реакцию, отдавая электроны, а другой электрод (катод) вступает в восстановительную реакцию, принимая электроны.
Примером химического источника электрического тока на основе взаимодействия металлов может служить гальваническая батарея. В такой батарее в качестве анода используется цинк, который окисляется, а в качестве катода – медь, которая восстанавливается. При этом возникает разница потенциалов между электродами, что и приводит к запуску тока через внешнюю цепь.
Основы химического источника электрического тока
Химический источник электрического тока представляет собой устройство, которое использует химическую реакцию для преобразования химической энергии в электрическую. Это достигается путем взаимодействия металлов или их оксидов в электролитической среде.
Основными компонентами химического источника электрического тока являются анод и катод, которые погружены в электролит. Анод - это металл или его оксид, который окисляется во время химической реакции, а катод - металл или оксид, который принимает электроны и восстанавливается. Эти процессы создают разность потенциалов между анодом и катодом, что позволяет течь электрическому току.
Важным аспектом химического источника электрического тока является выбор соответствующих материалов для анода и катода. Реакционные свойства выбранных материалов должны обеспечивать эффективное взаимодействие, чтобы обеспечить стабильное и длительное время работы источника тока.
Одним из распространенных примеров химического источника электрического тока является гальванический элемент или батарейка. В нем анодом часто выступает цинк, который окисляется, а катодом - медная пластина, которая принимает электроны и восстанавливается. Эта реакция создает электрический ток, который может использоваться для питания устройств.
Химические источники электрического тока широко применяются в различных областях, включая портативные электронные устройства, автомобильную промышленность и солнечную энергетику. Их преимуществами являются долгий срок службы, надежность и возможность перезарядки или замены элементов.
Металлы как основа химического источника электрического тока
Химический источник электрического тока на основе взаимодействия металлов или их оксидов является одним из наиболее распространенных и эффективных способов получения электроэнергии. Металлы, особенно в сочетании с другими элементами, обладают свойством образовывать электрохимические пары, которые способны передавать электроны из одного металла в другой при взаимодействии с электролитом.
Один из наиболее известных примеров таких химических источников электрического тока - гальванический элемент. В таком элементе металлы или их оксиды выступают в роли электродов, а электролитом служит раствор, который позволяет происходить обмену электронами между металлами. При этом происходит электрохимическая реакция, в результате которой осуществляется перераспределение электронов и внешний электрический ток начинает течь по внешней цепи.
Металлы также могут использоваться в качестве активного материала в батарейках и аккумуляторах. Это объясняется их способностью подвергаться окислительным и восстановительным процессам, обеспечивая электрохимические реакции внутри аккумулятора и осуществляя переход электронов из одного электрода в другой. Таким образом, металлы играют важную роль в создании стабильного и надежного источника электроэнергии.
Оксиды металлов для создания химического источника электрического тока
Оксиды металлов являются важными компонентами для создания химического источника электрического тока. Они широко используются в различных электрохимических системах, таких как батареи, аккумуляторы и топливные элементы.
Одним из наиболее распространенных оксидов металлов является оксид цинка (ZnO). Он обладает высокой электропроводностью и способностью легко вступать в реакции окисления-восстановления. Оксид цинка широко использовался в стандартных батареях и аккумуляторах.
Оксид магния (MgO) также является одним из наиболее важных оксидов металлов для создания химических источников электрического тока. Он обладает высокой стабильностью и электрохимической активностью. Оксид магния широко используется в литиевых и никелевых аккумуляторах.
Кроме оксида цинка и магния, существует множество других оксидов металлов, которые также находят применение в химических источниках электрического тока. Например, оксиды железа (Fe3O4, Fe2O3) используются в литий-ионных батареях, а оксиды кобальта (Co3O4) и марганца (MnO2) применяются в щелочных батареях и аккумуляторах.
В заключение, оксиды металлов являются неотъемлемыми компонентами для создания химического источника электрического тока. Их электрохимические свойства и стабильность играют важную роль в обеспечении эффективной работы различных электрохимических систем.
Применение металлов в химическом источнике электрического тока
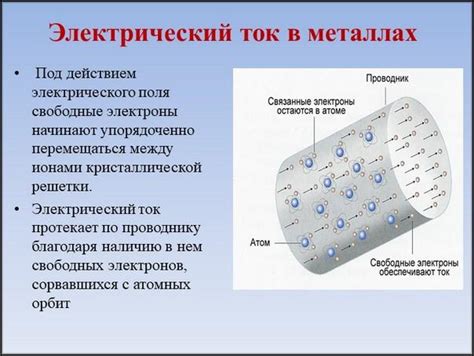
Металлы играют важную роль в химических источниках электрического тока. Они являются одним из основных компонентов таких источников, так как обладают способностью производить электрохимические реакции. Металлы обладают высокой проводимостью электрического тока и способностью активно взаимодействовать с другими веществами, что делает их идеальными материалами для создания элементов источников тока.
Активные металлы, такие как цинк, алюминий и железо, широко используются в химических источниках электрического тока. Они способны взаимодействовать с электрохимическими реагентами, такими как кислород и водород, и производить электрический ток. Например, в источниках тока на основе цинка и меди, цинк является активным металлом, который окисляется, а медь - непассивным металлом, который восстанавливается. Этот процесс вызывает появление электрического тока.
Оксидные составы металлов также широко применяются в химических источниках электрического тока. Например, в источниках тока на основе свинца и свинцового диоксида, свинец является активным металлом, а свинцовый диоксид - его оксидным составом. В ходе электрохимических реакций свинец окисляется и свинцовый диоксид восстанавливается, что приводит к генерации электрического тока.
Металлы играют основополагающую роль в разработке химических источников электрического тока. Их свойства и способность взаимодействовать с другими веществами делают их незаменимыми для создания эффективных источников тока, таких как батарейки и аккумуляторы. Благодаря применению металлов в химических источниках электрического тока, люди имеют доступ к электрической энергии, которая необходима для работы многих устройств и технологий в повседневной жизни.
Применение оксидов металлов в химическом источнике электрического тока
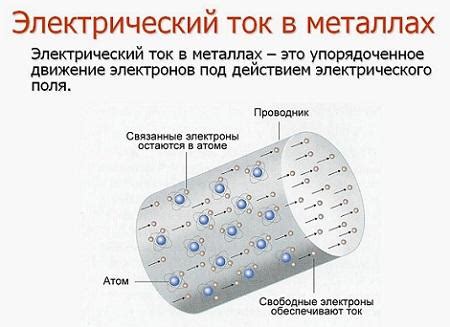
Оксиды металлов играют важную роль в химических источниках электрического тока. Эти вещества обладают уникальными свойствами, которые позволяют использовать их в качестве активных материалов для создания электродов.
Применение оксидов металлов в химических источниках электричества основано на их способности к электрохимическим реакциям. При наличии определенных условий оксиды металлов могут взаимодействовать с другими веществами, освобождая электрический заряд. Такие реакции происходят внутри электродов, которые являются составной частью химического источника тока.
Одним из примеров применения оксидов металлов является использование их в составе катода в гальванических элементах. При этом оксид металла взаимодействует с кислородом, освобождая электроны и создавая положительно заряженный ион. Этот процесс протекает на катоде и становится источником электродвижущей силы.
Некоторые оксиды металлов, такие как оксид цинка или оксид марганца, также применяются в составе анода в химических источниках тока. В процессе реакции эти оксиды переходят в другую форму соединения, освобождая электроны и создавая отрицательно заряженный ион. Энергия, выделяющаяся при этой реакции, используется для создания электрического тока.
Применение оксидов металлов в химическом источнике электрического тока позволяет получить устойчивый и длительный источник энергии. Эти вещества обладают высокой электропроводностью и химической активностью, что способствует эффективной передаче ионов и электронов в реакциях окисления и восстановления. Благодаря этому, оксиды металлов находят применение в различных областях, таких как батарейки, аккумуляторы и солнечные элементы.
Сравнение использования металлов и их оксидов в химическом источнике электрического тока
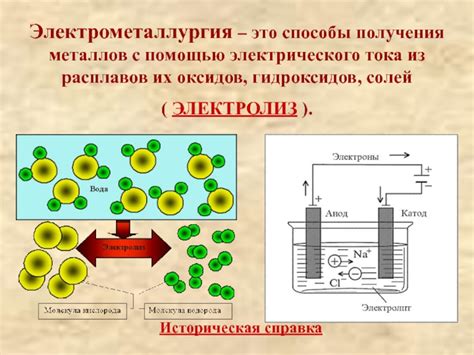
Химические источники электрического тока на основе взаимодействия металлов или их оксидов являются важным направлением развития энергетики и электроники. При выборе металлов или их оксидов для создания таких источников необходимо учитывать их химические свойства и электрохимическую активность.
Металлы и их оксиды обладают разной электрохимической активностью, которая определяет их способность подвергаться окислению или восстановлению. Металлы обычно имеют меньшую электрохимическую активность по сравнению с соответствующими оксидами. Это означает, что оксиды металлов могут быть более эффективными в качестве активных электродов, поскольку они способны образовывать на поверхности электрода ионы, участвующие в реакции.
Однако использование металлов в химическом источнике электрического тока также имеет свои преимущества. Металлы обычно обладают более высокой электропроводностью, поэтому они могут предоставлять более низкое внутреннее сопротивление и более высокий выходной ток. Кроме того, металлы могут образовывать более прочные и стабильные электроды, что способствует длительному сроку службы химического источника тока.
Возникает вопрос, какой выбрать материал для химического источника электрического тока: металл или его оксид? Ответ зависит от конкретного применения и требований к источнику. Если необходима высокая электропроводность и большой выходной ток, то лучше выбрать металл. В случае нужды в более эффективной реакции и длительном сроке службы источника, оксиды металлов будут более предпочтительными.
Вопрос-ответ

В чем заключается принцип работы химического источника электрического тока на основе взаимодействия металлов или их оксидов?
Принцип работы такого источника электрического тока основан на электрохимической реакции, которая происходит при контакте двух разных металлов или их оксидов с электролитом. Металлы или их оксиды действуют в качестве электродов, а электролит обеспечивает передвижение ионов между электродами. Эта реакция создает разность потенциалов между электродами, и в результате возникает электрический ток.
Какие металлы или их оксиды часто используются в химических источниках электрического тока?
Для химических источников электрического тока часто используются такие металлы, как цинк (Zn), алюминий (Al) и железо (Fe), а также их оксиды. Например, в односторонних батарейках (таких, как "АА") обычно используется цинк - цинк-гидроксидный химический источник тока. Эти металлы выбираются из-за их высокой активности и доступности.
Каковы преимущества использования химических источников электрического тока на основе взаимодействия металлов или их оксидов?
Использование таких химических источников электрического тока имеет несколько преимуществ. Во-первых, они обычно дешевле, чем другие типы батарей, и позволяют получить большой запас энергии. Во-вторых, они имеют длительный срок службы и способны сохранять мощность даже при хранении. Кроме того, такие источники не нуждаются во внешнем источнике энергии и легко заменяются при истощении. Они также довольно безопасны в использовании и не содержат вредных веществ.
