Щелочные металлы – это одна из основных групп элементов в периодической системе химических элементов. В этой группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют ряд характерных особенностей и применяются в различных областях жизни.
Щелочные металлы обладают высокой реактивностью и активностью. Они легко образуют ионы положительного заряда и обладают групповым зарядом +1. Природные соединения щелочных металлов широко распространены и встречаются в различных минералах, солевых отложениях и горных породах. Щелочные металлы также являются необходимыми элементами в организмах живых существ и используются в биологических процессах.
На уроках химии в 9 классе вы будете изучать основные свойства и химические реакции щелочных металлов. Это поможет вам лучше понять и овладеть знаниями об этой группе элементов. При подготовке к химическому диктанту рекомендуется уделить особое внимание основным характеристикам щелочных металлов, их свойствам и использованию в различных областях жизни.
Изучение щелочных металлов поможет вам не только успешно пройти диктант, но и расширить свои химические знания, которые будут полезны в будущем. Удачи в подготовке и успехов на уроках химии!
Химический диктант: основы щелочных металлов для 9 класса

Щелочные металлы, также известные как первая группа периодической системы, представляют собой весьма реактивные элементы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы характеризуются низкой плотностью и низкой температурой плавления, они очень мягкие и легко режутся ножом.
Главной характеристикой щелочных металлов является их активность. Они активно реагируют с водой, кислотами и некоторыми другими веществами. Например, при контакте с водой щелочные металлы выделяют водород, а в случае реакции с кислородом они могут воспламеняться. Также щелочные металлы образуют оксиды, которые растворяются в воде и дают щелочные растворы.
Литий является самым легким и наиболее реактивным из всех щелочных металлов. Его соединения широко используются в различных областях, включая производство батареек, лекарств и керамики. Натрий также широко используется, особенно в пищевой промышленности для приготовления различных продуктов.
- Калий имеет большое значение для растений и является необходимым элементом для их роста и развития.
- Рубидий и цезий имеют очень маленькую распространенность в земной коре и используются главным образом в научных исследованиях.
- Франций является самым редким и радиоактивным из всех щелочных металлов, его соединения изучаются в основном в лабораторных условиях.
Изучение основ щелочных металлов поможет ученикам понять их химические свойства и реактивность. Знакомство с этой группой элементов открывает двери в мир химии и стимулирует интерес к дальнейшему изучению химических процессов.
Щелочные металлы: что это?
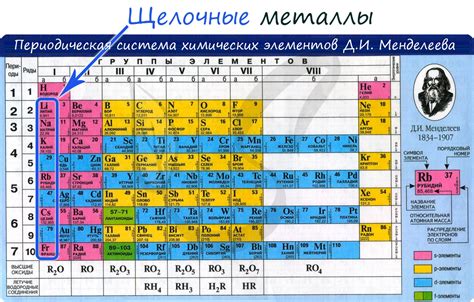
Щелочные металлы – это группа химических элементов, которые находятся в первой группе таблицы периодических элементов. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются металлами с очень низкой плотностью, мягкими и легко реагирующими с водой и кислородом.
Особенностью щелочных металлов является то, что они имеют одну электронную оболочку, которая содержит всего один электрон. Это делает их очень реакционноспособными элементами. Вода является одним из наиболее известных реагентов для щелочных металлов, так как они реагируют с водой с выделением водорода.
Щелочные металлы имеют широкие применения в различных отраслях науки и промышленности: от производства щелочных батарей и стекол до использования в процессах синтеза химических соединений. Более того, некоторые щелочные металлы, такие как калий и натрий, являются необходимыми элементами для поддержания жизни организмов.
Элементы группы щелочных металлов имеют схожие свойства и химические реактивности. Они хорошо растворяются в воде и имеют высокую тепло- и электропроводность. Также, щелочные металлы образуют соли при реакции с кислотами.
Свойства щелочных металлов

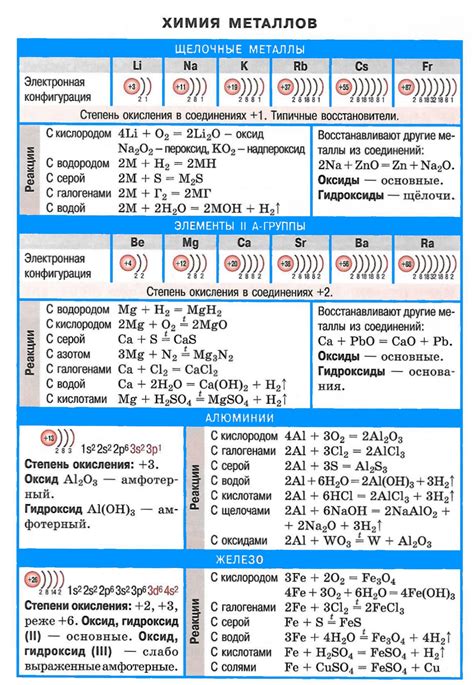
1. Химическая активность: Щелочные металлы являются одними из самых химически активных элементов. Они легко реагируют с водой, кислородом и другими веществами, выделяя большое количество энергии.
2. Металлический блеск: В связи с высокой реактивностью, щелочные металлы всегда имеют свежий металлический блеск. Они легко окисляются на воздухе, при этом покрываются оксидной пленкой.
3. Низкая плотность: Щелочные металлы обладают очень низкой плотностью, что делает их легкими и мягкими материалами. Например, литий имеет плотность всего 534 кг/м³.
4. Низкая температура плавления: По сравнению с другими металлами, щелочные металлы имеют относительно низкую температуру плавления. Калий, например, плавится при температуре 63°C.
5. Одноатомный ион: В химических реакциях щелочные металлы образуют одноатомные ионы с положительным зарядом. Например, ион натрия имеет заряд +1.
6. Щелочные оксиды: В результате реакции с кислородом, щелочные металлы образуют щелочные оксиды. Например, оксид натрия образуется при сжигании натрия на воздухе.
7. Щелочные гидроксиды: Взаимодействуя с водой, щелочные металлы образуют щелочные гидроксиды. Например, гидроксид натрия образуется при взаимодействии натрия с водой.
8. Щелочные соли: Щелочные металлы образуют щелочные соли, которые широко используются в промышленности и в повседневной жизни. Например, хлорид натрия применяется в пищевой промышленности как пищевая добавка.
9. Высокая электропроводность: Щелочные металлы обладают высокой электропроводностью и широко используются в производстве батарей, аккумуляторов и других электронных устройств.
Реакции щелочных металлов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают свойством активно взаимодействовать с водой и кислородом. Их реакции с водой известны как гидролиз.
Реакция щелочного металла с водой приводит к образованию гидроксида металла и выделению водорода. Реактивность щелочных металлов увеличивается при переходе от лития к цезию. Например, литий активно реагирует с водой и вызывает ее воспламенение, при этом слабые искры и пузырьки водорода образуются на поверхности металла.
При реакции с кислородом щелочные металлы образуют оксиды металлов. Например, натрий при взаимодействии с кислородом образует оксид натрия (Na2O), а литий образует оксид лития (Li2O). Эти оксиды являются щелочными оксидами и проявляют щелочные свойства. Они реагируют с водой, образуя гидроксиды металлов.
Щелочные металлы также могут реагировать с кислотами, образуя соли и высвобождая водород. Эти реакции являются типичными реакциями нейтрализации. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода.
Применение щелочных металлов

Натрий: Натрий широко применяется в пищевой промышленности для консервирования, регулирования кислотности и поддержания вкуса продуктов. Он также используется для производства щелочей, мыла и стекла.
Калий: Калий используется в сельском хозяйстве для удобрений, так как является необходимым элементом для роста растений. Он также используется в производстве стали, прозрачного стекла и в медицине для регулирования уровня электролитов в организме.
Литий: Литий используется в производстве аккумуляторов, так как обладает высокой энергетической плотностью и стабильностью. Он также используется в лечении психических расстройств и биполярного аффективного расстройства.
Рубидий: Рубидий используется в электронике для создания специальных видов лазеров и оптических приборов. Он также применяется в производстве специальных стекол, металлов и катализаторов.
Цезий: Цезий находит применение в научных исследованиях и разработке, так как обладает особыми оптическими свойствами. Он также используется в электронике и военной технике для создания высокочастотных генераторов и детекторов.
Франций: Франций является самым редким элементом среди щелочных металлов и его применение ограничено. Он используется в научных исследованиях и воздухоплавании, так как обладает очень низкой температурой плавления.
Вопрос-ответ

Какие вещества относятся к щелочным металлам?
К щелочным металлам относятся: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие основные свойства щелочных металлов?
У щелочных металлов есть несколько основных свойств: они обладают металлическим блеском, мягкостью, низкой плотностью и реакционностью. Они активно взаимодействуют с водой, образуя щелочные растворы и выделяя водород. Кроме того, щелочные металлы имеют низкую температуру плавления и кипения и образуют ионы с положительным зарядом.
Какие использования есть для щелочных металлов в промышленности?
Щелочные металлы имеют широкое применение в промышленности. Например, натрий используется для производства стекла, калий - для производства удобрений, а рубидий и цезий могут использоваться в ядерной энергетике и оптических приборах. Литий также нашел применение в производстве лекарств и аккумуляторных батарей.
Как происходит реакция щелочных металлов с водой?
Реакция щелочных металлов с водой происходит очень быстро и с выделением водорода. При взаимодействии с водой металлы образуют щелочные растворы, например, гидроксиды. Уравнение реакции выглядит следующим образом: 2M + 2H₂О → 2MOH + H₂, где M - щелочной металл, H₂О - вода, MOH - щелочной гидроксид.
