Химические уравнения с металлами являются важным компонентом химии и играют ключевую роль в описании химических реакций, связанных с металлами. Металлы входят в состав многих веществ и имеют специфические свойства, которые могут быть изучены и описаны с помощью химических уравнений.
В химических уравнениях с металлами указываются реагенты (вещества, взаимодействующие между собой) и продукты реакции (новые вещества, образовавшиеся в результате химической реакции). Коэффициенты перед формулами веществ указывают на их количественное соотношение в реакции.
Химические уравнения с металлами могут описывать различные процессы, связанные с металлами, такие как окисление и восстановление, образование солей, образование сплавов и другие. Они позволяют предсказывать химические реакции, прогнозировать и контролировать их ход, а также изучать свойства и поведение металлов в различных условиях.
Правильное составление химических уравнений с металлами требует знания основных принципов реакций и умения распознавать типы химических связей и реакций. Также необходимо учитывать валентность металла и других элементов, участвующих в реакции, а также принимать во внимание условия, при которых происходит реакция.
В данной статье мы рассмотрим основные типы химических уравнений с металлами, их правила составления и решения. Мы также рассмотрим примеры химических реакций с различными металлами, чтобы лучше понять их строение и свойства. Полное понимание химических уравнений с металлами позволит вам глубже изучить металлургию, химию и другие науки, связанные с металлами.
Основные понятия
Химическое уравнение – это представление химической реакции с использованием химических формул веществ. Химические уравнения позволяют описать соотношение между реагентами и продуктами реакции.
Реагенты – это начальные вещества в химической реакции. Они участвуют в реакции и претерпевают изменения, превращаясь в продукты.
Продукты – это вещества, которые образуются в результате химической реакции. Они возникают из реагентов и имеют другие химические свойства.
Коэффициенты в химическом уравнении – числа, которые ставят перед формулами веществ, чтобы соблюсти закон сохранения массы. Они показывают отношение количества веществ в реакции и используются для балансировки уравнений.
Балансировка химического уравнения – процесс установления соотношения между количеством реагентов и продуктов в химической реакции. Балансировка выполняется путем добавления коэффициентов перед формулами веществ таким образом, чтобы сумма атомов каждого элемента в реагентах равнялась сумме атомов этого элемента в продуктах.
Окислительно-восстановительная реакция – это химическая реакция, в которой происходит передача электронов от одного вещества к другому. Окислители получают электроны, восстановители отдают электроны. Такие реакции играют важную роль во многих процессах, включая коррозию металлов и синтез органических соединений.
Агрегатные состояния веществ – это различные формы, в которых могут находиться вещества: твердое, жидкое и газообразное. Агрегатное состояние вещества может меняться при химической реакции, что приводит к образованию новых продуктов.
Примеры уравнений с металлами
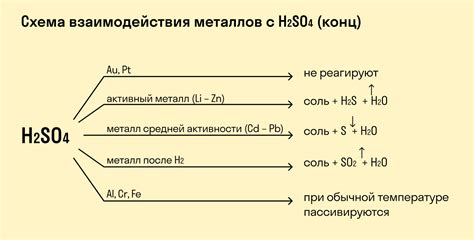
Металлы являются одними из основных участников химических реакций. В химических уравнениях они представлены в виде ионов или атомов, участвующих в различных реакциях. Рассмотрим несколько примеров уравнений с металлами.
1. Реакция цинка с кислотой:
Когда цинк вступает в реакцию с кислотой, например с соляной кислотой (HCl), образуется соль и выделяется водород. Уравнение реакции:
Zn + 2HCl → ZnCl2 + H2
2. Реакция железа с кислородом:
При нагревании железа на воздухе происходит реакция железа с кислородом, в результате которой образуется оксид железа (III). Уравнение реакции:
4Fe + 3O2 → 2Fe2O3
3. Реакция алюминия с хлором:
Реакция алюминия с хлором приводит к образованию хлорида алюминия. Уравнение реакции:
2Al + 3Cl2 → 2AlCl3
4. Реакция меди с серной кислотой:
При взаимодействии меди с серной кислотой образуется сульфат меди и выделяется диоксид серы. Уравнение реакции:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
5. Реакция свинца с нитратом серебра:
Обработка свинца нитратом серебра приводит к образованию нитрата свинца и осаждению серебра. Уравнение реакции:
Pb + 2AgNO3 → Pb(NO3)2 + 2Ag
Это лишь несколько примеров уравнений с металлами, демонстрирующих их участие в различных химических реакциях. Изучение таких реакций позволяет лучше понять свойства и поведение металлов в химических системах.
Способы балансировки уравнений

Балансировка химических уравнений является важным шагом при решении задач химических реакций. Балансировка проводится для того, чтобы количество атомов каждого элемента в реакции соответствовало закону сохранения массы. Существуют несколько способов балансировки уравнений, включая методы подстановки, методы алгебраической балансировки и методы ионно-электронного балансирования.
Один из наиболее распространенных способов балансировки уравнений - это метод подстановки. Для начала, мы выбираем элемент, у которого количество атомов в реакции неравно числу атомов на другой стороне уравнения. Затем, мы добавляем или изменяем коэффициенты перед соответствующими соединениями, чтобы количество атомов стало равным. Продолжаем этот процесс для всех элементов, пока уравнение не станет сбалансированным.
Второй метод - это алгебраическая балансировка. Мы можем использовать систему уравнений для определения значений коэффициентов перед соединениями. Коэффициенты выбираются таким образом, чтобы количество атомов каждого элемента было одинаковым по обеим сторонам уравнения. Путем решения системы уравнений можно получить правильные коэффициенты и сбалансированное химическое уравнение.
Третий метод - ионно-электронное балансирование. Он используется для балансировки реакций в растворах, где происходят окислительно-восстановительные реакции. В этом методе мы балансируем количество ионов и электронов на обеих сторонах уравнения, чтобы достичь электрической нейтральности.
Каждый из этих способов балансировки уравнений имеет свои особенности и может быть применим в разных ситуациях. Важно уметь применять все эти методы, чтобы успешно балансировать химические уравнения с металлами.
Метод подстановки

Метод подстановки — это один из методов решения уравнений, используемых в химии для балансировки химических уравнений. Он основан на подстановке различных коэффициентов перед нереагирующими веществами и их сравнении с коэффициентами перед реагирующими веществами.
Суть метода подстановки заключается в том, что мы предполагаем какие-то начальные коэффициенты перед реагирующими веществами и проверяем, соблюдается ли закон сохранения массы в данном случае. Если закон не соблюдается, то мы меняем значения коэффициентов и повторяем процесс до тех пор, пока не достигнем соблюдения закона сохранения массы.
Для применения метода подстановки необходимо воспользоваться механизмом систематического перебора всех возможных комбинаций коэффициентов перед реагирующими веществами. Начиная с простых чисел и последовательно изменяя их значения, мы проверяем, соблюдается ли закон сохранения массы. Таким образом, метод подстановки позволяет найти правильные значения коэффициентов перед реагирующими веществами и балансировать химическое уравнение.
Применение метода подстановки требует тщательности и систематичности. Необходимо провести все возможные комбинации и проверить каждую из них на соблюдение закона сохранения массы. Хотя этот метод может занять некоторое время, он позволяет эффективно балансировать химическое уравнение и получать верные результаты.
Метод окислительно-восстановительных реакций

Метод окислительно-восстановительных реакций является одним из основных способов в химии для анализа и определения окислительных свойств металлов. Этот метод основан на изменении степени окисления металла в процессе реакции с оксидантом или восстановителем.
В окислительно-восстановительных реакциях металл переходит из одного окислительного состояния в другое. Оксидант – вещество, которое приводит к окислению металла, уходу электронов с его атомов и повышению степени окисления. Восстановитель – вещество, способное принять эти электроны и снизить степень окисления металла.
Примером хорошо известной окислительно-восстановительной реакции является реакция, во время которой железо (Fe) окисляется, а хлор (Cl) восстанавливается. Результатом этой реакции является образование хлорида железа (FeCl3):
- 2Fe(s) + 3Cl2(g) → 2FeCl3(s)
Окислительно-восстановительные реакции также широко применяются в аналитической химии для определения содержания металлов в различных образцах и растворах. При помощи таких реакций можно определить степень окисления металла и его концентрацию в пробе. Этот метод находит применение в таких областях, как анализ воды, пищевой промышленности и медицинской диагностики.
Особенности уравнений с металлами

Химические уравнения с металлами имеют свои особенности, которые важно учитывать при их составлении и решении. Во-первых, металлы могут образовывать ионы положительного заряда, которые являются катионами. Это означает, что при реакции с кислородом или другими веществами, металл может участвовать в обмене электронами.
Во-вторых, уравнения с металлами могут иметь разные степени окисления для одного и того же элемента. Например, железо может иметь степени окисления Fe2+ и Fe3+. Это важно учитывать при соединении металлов с другими веществами, чтобы правильно указать степень окисления металла.
Для уравнений с металлами также характерны реакции образования металлических сплавов. При взаимодействии двух разных металлов, они могут образовывать сплав с новыми свойствами. Например, латунь - это сплав меди и цинка, который обладает хорошей коррозионной стойкостью.
Для удобства записи и сравнения химических уравнений с металлами можно использовать таблицы степеней окисления и таблицы реактивности металлов. Они помогут определить правильные коэффициенты перед формулами веществ и соблюсти баланс химических уравнений.
Взаимодействие с кислородом
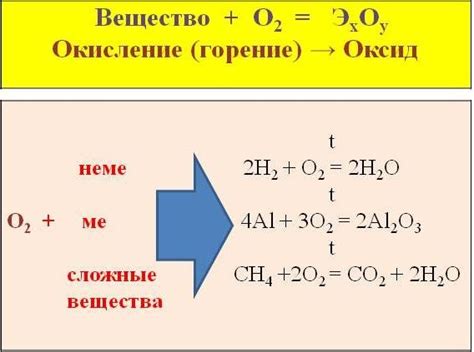
Металлы могут взаимодействовать с кислородом, приводя к образованию оксидов. Это происходит благодаря активной природе металлов, которая заключается в их способности отдавать электроны.
Взаимодействие металлов с кислородом особенно ярко проявляется в реакции с воздухом. При контакте с кислородом воздуха многие металлы начинают окисляться и образовывать оксидные пленки на своей поверхности. Эти пленки защищают металл от дальнейшего окисления и коррозии.
В зависимости от конкретного металла и условий окружающей среды, образуемые оксиды могут быть различными по своим свойствам и цвету. Например, железо при окислении образует оксид железа (Fe2O3), который имеет красный оттенок. Алюминий при окислении образует оксид алюминия (Al2O3), который имеет белый цвет и является хорошим изолятором.
- Металлы могут взаимодействовать с кислородом настолько интенсивно, что запускают горение.
- Некоторые металлы, такие как литий и магний, могут вступать в реакцию с кислородом даже при комнатной температуре.
- Взаимодействие металлов с кислородом играет важную роль в промышленных процессах, таких как производство стали и алюминия.
- Окислительные реакции металлов с кислородом могут быть использованы для получения энергии в химических батареях и гальванических элементах.
Выделение металлов

Выделение металлов - это процесс получения металлов из их руд, растворов или сплавов. Существует несколько методов выделения металлов, включая обогащение руд, плавку сплавов или электролиз. Каждый метод имеет свои преимущества и особенности.
Одним из методов выделения металлов является обогащение руд. Этот процесс включает различные этапы, такие как дробление, помол, флотация и гидрометаллургическую обработку, и позволяет получать высококачественную руду, богатую нужными металлами.
Еще одним методом выделения металлов является плавка сплавов. Сплавы, содержащие целевой металл, нагреваются до определенной температуры, при которой целевой металл плавится и может быть отделен от других компонентов сплава. Этот метод часто используется для получения чистых или специальных металлов, таких как алюминий или титан.
Третьим распространенным методом выделения металлов является электролиз. В этом процессе металлы выделяются из их растворов при помощи электрического тока. Во время электролиза ионы металлов притягиваются к электродам и осаждаются на них в виде чистого металла. Этот метод особенно полезен для выделения металлов, которые не могут быть получены другими способами.
Вопрос-ответ

Что такое химические уравнения с металлами?
Химические уравнения с металлами - это уравнения реакций, в которых металлы участвуют как реагенты или продукты реакции. В таких уравнениях показывается, как происходит химическая реакция между металлом и другими веществами.
Какие металлы могут участвовать в химических реакциях?
Многие металлы могут участвовать в химических реакциях. Некоторые наиболее часто встречающиеся металлы, такие как железо, медь, алюминий и цинк, реагируют с кислотами, оксидами и другими веществами, образуя новые соединения. Другие металлы, такие как золото и платина, обычно менее активны и редко участвуют в химических реакциях.
