Земельно щелочные металлы – это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются первыми шестью элементами I группы периодической системы и характеризуются сходными свойствами. У всех земельно щелочных металлов одинаковая электронная конфигурация в внешнем энергетическом слое, что обуславливает их схожее поведение в химических реакциях.
Основные химические свойства земельно щелочных металлов связаны с их активностью и металлическими свойствами. Они реагируют с водой с образованием щелочи и выделением водорода. Например, натрий при реакции с водой образует гидроксид натрия (щелочь) и выделяет водород. Это явление называется «щелочной металл действует на воду» и является характерным для всех земельно щелочных металлов.
Земельно щелочные металлы также обладают инертностью в атмосфере. Они не реагируют с обычными газами воздуха, такими как кислород и азот. Однако, при взаимодействии с воздухом они образуют оксидные пленки, которые покрывают их поверхность. Эта пленка защищает металл от дальнейшего окисления.
Реакция с водой и кислотами

Химические свойства земельно щелочных металлов проявляются в их реакции с водой и кислотами. Реакция с водой является характерной особенностью щелочных металлов и происходит с выделением водорода.
Например, реакция натрия с водой проводится так: Na + H2O → NaOH + H2. В результате щелочный гидроксид натрия и высвободившийся водород образуются. Эта реакция является очень энергичной и сопровождается выделением большого количества тепла.
Когда щелочные металлы реагируют с кислотой, происходит образование соли и выделение водорода. Например, реакция натрия с соляной кислотой выглядит так: 2Na + 2HCl → 2NaCl + H2. В результате образуется хлорид натрия и высвобождается водород. Эта реакция также сопровождается выделением тепла.
Реакция щелочных металлов с водой и кислотами является важной химической реакцией, которая демонстрирует их физические и химические свойства. Эти реакции имеют широкое применение в различных отраслях науки и техники.
Образование оксидов и гидроксидов

Земельно-щелочные металлы, такие как натрий, калий, литий и другие, характеризуются своей способностью образовывать оксиды и гидроксиды.
Оксиды земельно-щелочных металлов образуются при реакции с кислородом или при высокой температуре. Например, натрий образует оксид Na2O, а калий - оксид KO.
Гидроксиды земельно-щелочных металлов образуются при растворении оксидов или реакции с водой. Например, натрий образует гидроксид NaOH, а калий - гидроксид KOH.
Гидроксиды земельно-щелочных металлов обладают щелочными свойствами и образуют растворы с pH значением выше 7. Они являются сильными основаниями и широко используются в промышленности и в быту.
Образование оксидов и гидроксидов земельно-щелочных металлов может быть использовано в различных процессах, таких как производство стекла, мыла, щелочей и других продуктов.
Взаимодействие с кислородом и озоном
Земельно-щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), проявляют различные реакции при взаимодействии с кислородом (O2) и озоном (O3).
Самым активным из этих металлов является литий, который при нагревании с кислородом образует оксид лития (Li2O). Этот оксид является белым порошком, легкорастворимым в воде и обладает щелочными свойствами.
Натрий и калий образуют те же соединения с кислородом, что и литий, то есть оксиды натрия (Na2O) и калия (K2O). Однако в отличие от лития эти соединения имеют более слабое щелочное действие и меньшую растворимость в воде.
Рубидий и цезий, наиболее тяжелые из земельно-щелочных металлов, при взаимодействии с кислородом образуют оксиды рубидия (Rb2O) и цезия (Cs2O). Эти соединения также обладают щелочными свойствами, но имеют очень низкую растворимость в воде и образуют более тугоплавкие кристаллы.
Взаимодействие земельно-щелочных металлов с озоном протекает похожим образом. Однако оксиды, образующиеся при этом, обладают более высокой окислительной активностью, поэтому реакция проходит более интенсивно. Кроме того, озон также может образовывать пероксиды с земельно-щелочными металлами, которые характеризуются еще более высокой активностью и реактивностью.
Реакция с аммиаком и аминами
Земельно щелочные металлы, такие как натрий (Na), калий (K) и рубидий (Rb), проявляют активность при взаимодействии с аммиаком (NH3) и аминами. В результате этих реакций образуются гидроксиды металлов и аммиакаты или аминаты.
Реакция земельно щелочных металлов с аммиаком протекает с выделением водорода и образованием аммиаката металлов. Например, сильное взаимодействие натрия с аммиаком приводит к образованию аммиаката натрия (NaNH2) и выделению водорода:
2Na + 2NH3 → 2NaNH2 + H2
Реакция земельно щелочных металлов с аминами происходит аналогичным образом. Например, реакция калия с моноэтаноламином (HOCH2CH2NH2) приводит к образованию амината калия (KOC2H4NH2) и выделению водорода:
2K + 2HOCH2CH2NH2 → 2KOC2H4NH2 + H2
Подобные реакции с аммиаком и аминами позволяют использовать земельно щелочные металлы для получения аммиакатов и аминатов, которые являются важными промежуточными продуктами в химическом производстве и синтезе органических соединений.
Образование солей
Земельно-щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой реакционной способностью и легко образуют соли. Образование солей происходит при реакции металла с кислотой или основанием.
В результате реакции металла с кислотой образуются соли и выделяется водород. Например, реакция лития с соляной кислотой приводит к образованию соли – хлорида лития и выделению водорода:
2Li + 2HCl → 2LiCl + H2
Реакция металла с основанием также приводит к образованию соли. Например, реакция натрия с гидроксидом натрия приведет к образованию соли – гидроксида натрия и выделению водорода:
2Na + 2NaOH + 2H2O → 2NaOH2 + H2
Образование солей также может происходить при реакции металла с солями других металлов. В результате такой реакции происходит обмен ионами, и образуется новая соль. Например, реакция калия с хлоридом меди приведет к образованию соли – хлорида калия и меди:
2K + 2CuCl2 → 2KCl + Cu
Таким образом земельно-щелочные металлы обладают способностью образовывать соли при взаимодействии с различными веществами.
Взаимодействие с галогенами
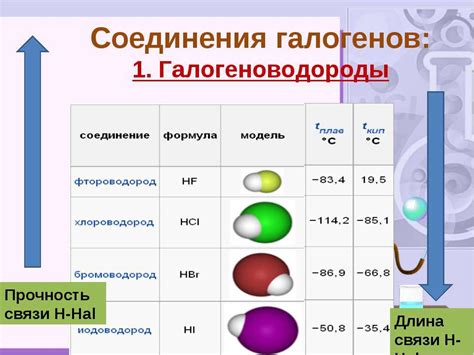
Земельные щелочные металлы проявляют активное взаимодействие с галогенами – фтором, хлором, бромом, йодом. При этом образуются соли галогенидов металлов. Это взаимодействие происходит в результате обмена ионов между металлом и галогеном.
Самое интенсивное взаимодействие земельно щелочных металлов наблюдается с фтором, так как фтор обладает наибольшей электроотрицательностью. В результате реакции с фтором образуются бинарные соединения, которые имеют характерную кристаллическую структуру и высокие температуры плавления.
Взаимодействие земельных щелочных металлов с хлором, бромом и йодом происходит менее интенсивно по сравнению с фтором. В результате реакции с хлором и бромом образуются хлориды и бромиды металлов соответственно. Реакция с йодом наиболее медленная и идет при повышенных температурах.
Физические и химические свойства солей галогенидов земельно щелочных металлов зависят от их состава и структуры. Эти соединения обладают высокой растворимостью в воде и образуют кристаллы с определенной геометрической формой. Они также обладают высокой электропроводностью и важным каталитическим свойством.
Взаимодействие с сернокислыми газами
Земельно щелочные металлы обладают высокой реакционной способностью и способны взаимодействовать с различными веществами. В частности, они проявляют активность при взаимодействии с сернокислыми газами.
Дата Калием, натрием и другими земельно щелочными металлами может происходить реакция со сернистым газом (SO2), сернистым ангидридом (SO3) и серной кислотой (H2SO4). Эти реакции протекают с образованием растворимых солей и сульфатов земельно щелочных металлов.
Реакция земельно щелочных металлов с сернокислыми газами приводит к образованию оснований, а именно сульфатов земельно щелочных металлов. Например, калий реагирует с сернистым газом с образованием сульфата калия:
- К + SO2 → K2SO3
Схожая реакция происходит и с натрием:
- 2Na + SO2 → Na2SO3
Сернистый ангидрид и серная кислота также способны реагировать с земельно щелочными металлами, образуя сульфаты. Например, реакция серной кислоты с калием протекает следующим образом:
- 2KOH + H2SO4 → K2SO4 + 2H2O
Следует отметить, что эти реакции являются экзотермическими и сопровождаются выделением тепла. Также они протекают с высвобождением газообразных продуктов, что может сопровождаться появлением пузырьков или вспениванием реакционной смеси.
Взаимодействие с переходными металлами

Переходные металлы являются одними из наиболее активных веществ, которые могут взаимодействовать с земельно щелочными металлами. Благодаря своей химической активности, переходные металлы способны образовывать соединения с различными элементами в периодической таблице.
Одним из наиболее известных примеров взаимодействия земельно щелочных металлов с переходными металлами является образование сплавов. Сплавы представляют собой смеси металлов, в которых земельно щелочные металлы являются основным компонентом, а переходные металлы добавляются для придания особых свойств и характеристик таких, как прочность, твердость, стойкость к коррозии и др.
Кроме того, земельно щелочные металлы могут вступать в реакции с переходными металлами и образовывать различные соединения. Например, образование солей, оксидов и гидроксидов. Эти соединения имеют различные свойства и могут использоваться в различных областях промышленности и науки.
Важно отметить, что взаимодействие земельно щелочных металлов с переходными металлами может происходить под воздействием различных условий, таких как температура, давление, концентрация и другие. Кроме того, реакция может протекать в разных направлениях в зависимости от свойств и соотношения элементов, участвующих в реакции.
Вопрос-ответ

Какие химические свойства имеют земно-щелочные металлы?
Земно-щелочные металлы обладают несколькими химическими свойствами. Они хорошо растворяются в воде, образуя щелочные растворы. Эти металлы нестабильны в воздухе и быстро окисляются, поэтому их обычно хранят в специальных сосудах с инертной средой. Они также обладают высокой электроотрицательностью и способны образовывать ионы с положительным зарядом.
Почему земно-щелочные металлы хорошо растворяются в воде?
Земно-щелочные металлы хорошо растворяются в воде из-за своего химического строения. Они образуют ионы с положительным зарядом, которые притягивают отрицательно заряженные ионы воды. Это позволяет металлам легко растворяться, образуя щелочные растворы.
Какие примеры земно-щелочных металлов существуют?
Примерами земно-щелочных металлов являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все они относятся к первой группе периодической системы химических элементов.
Каким образом земно-щелочные металлы окисляются в воздухе?
Земно-щелочные металлы окисляются в воздухе путем реакции с кислородом. По мере окисления металлов создаются оксиды, которые образуют пленку на поверхности металла. Эта пленка обычно темная или цветная и защищает металл от дальнейшей реакции с окислителями.
Для чего хранят земно-щелочные металлы в специальных сосудах?
Земно-щелочные металлы, такие как литий, натрий и калий, нестабильны в воздухе и быстро окисляются. Поэтому их обычно хранят в специальных сосудах с инертной средой, например, в вакууме или под слоем масла. Это предотвращает их реакцию с окислителями и сохраняет их надолго.
