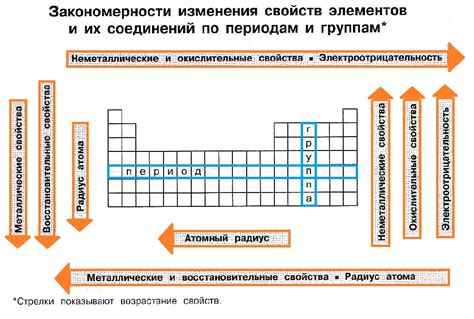
Химические свойства металлов определяются их способностью вступать в химические реакции. Металлы образуют большое количество соединений, их реакции часто сопровождаются образованием или поглощением тепла, появлением пламени или газовых пузырьков. Популярное выражение "уравнение задает реакцию" идеально описывает особенности химических реакций металлов.
Например, реакция метала с кислотой хорошо известна иллюстрацией уравнения задает реакцию. Когда металл вступает в контакт с кислотой, происходит химическая реакция, в результате которой образуются соль и водород. Это можно представить в виде уравнения:
Металл + кислота → соль + водород
Это уравнение позволяет точно описать происходящую реакцию и показывает, какие вещества образуются в результате взаимодействия металла и кислоты. Конкретные металлы и кислоты могут быть заменены в уравнении, что позволяет предсказывать химическую реакцию и исследовать влияние разных факторов на процесс.
Уравнение задает реакцию также может описывать химические реакции металлов с другими веществами, например, с окислителями или основаниями. При взаимодействии металлов с окислителями может происходить окисление металла, образование окиси металла или соединения более высокой степени окисления. Реакция металла с основанием часто приводит к образованию соли и выделению воды.
Важность химических свойств металлов
Химические свойства металлов играют значительную роль в нашей жизни. Металлы являются одним из основных строительных материалов, благодаря своей прочности и долговечности.
Кроме того, металлы широко используются в промышленности, включая машиностроение, автомобильное производство, электронику и другие отрасли. Их химические свойства позволяют создавать различные сплавы с желаемыми свойствами, такими как прочность, устойчивость к коррозии или электропроводность.
Еще одно важное химическое свойство металлов - их способность взаимодействовать с другими веществами и участвовать в химических реакциях. Многие промышленные процессы основаны на реакциях с участием металлов, например, процесс гальванизации или производство стали.
Также металлы играют важную роль в медицине. Некоторые металлы используются для создания медицинских инструментов и протезов, так как они обладают биосовместимостью и хорошо переносятся организмом. Благодаря химическим свойствам металлов, таких как антимикробные свойства серебра, удастся создавать новые материалы и технологии в медицине.
Химическая реакция металлов
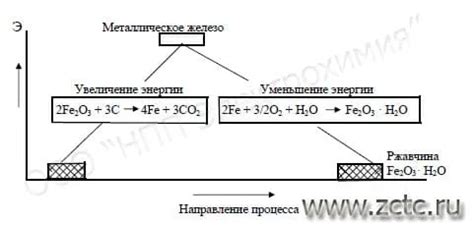
Химическая реакция металлов — это процесс, в ходе которого металлы образуют новые вещества путем взаимодействия с другими веществами или средами. Реакция металлов может происходить с кислородом, водой, кислотами и щелочами.
Реакция металлов с кислородом приводит к образованию оксидов металлов. Например, железо при контакте с влажным воздухом окисляется, образуя ржавчину. Реакция алюминия с кислородом порождает окись алюминия.
Реакция металлов с водой может быть различной в зависимости от их активности. Активные металлы, такие как натрий или калий, реагируют с водой с выделением водорода и образованием оснований. Менее активные металлы, например, железо или цинк, могут реагировать только при нагревании или при наличии катализатора.
Реакция металлов с кислотами приводит к образованию солей и выделению водорода. Например, цинк и серная кислота реагируют и образуют сульфат цинка и выделяются пузырьки водорода. Этот процесс широко используется при получении водорода.
Реакция металлов с щелочами также приводит к образованию солей и выделению водорода. Натрий и щелочные гидроксиды взаимодействуют, образуя соль и выделяя водород.
Уравнение химической реакции

Уравнение химической реакции представляет собой символьную запись превращений, происходящих между веществами. В уравнении присутствуют начальные вещества (реагенты) и конечные вещества (продукты), а также коэффициенты перед формулами веществ, которые показывают их количественное соотношение в реакции.
Уравнение химической реакции должно быть сбалансировано, то есть количество атомов каждого элемента с одной стороны уравнения должно быть равно количеству атомов этого элемента с другой стороны уравнения. Балансировка уравнения позволяет соблюдать закон сохранения массы и закон сохранения атомной составляющей во время химической реакции.
Уравнение химической реакции может быть использовано для решения различных задач. Например, с помощью уравнения можно определить количество реагентов, необходимых для проведения реакции, или количество продуктов, получаемых при заданных условиях.
При записи уравнений химических реакций следует учитывать не только соотношение веществ, но и фазовые состояния (газ, жидкость, твердое вещество) и состояние вещества (элемент, соединение или ион). В уравнении также могут присутствовать коэффициенты активности, которые показывают, насколько активно участвует данное вещество в реакции.
Взаимодействие металлов с другими веществами
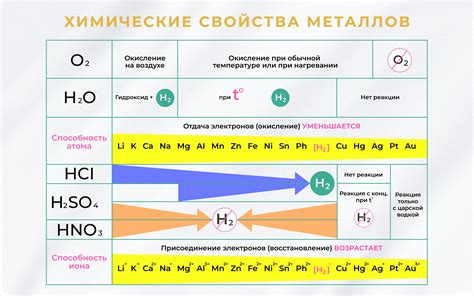
Металлы обладают способностью вступать во взаимодействие с различными веществами и проявлять химические свойства. При этом характер реакции зависит от свойств металла и вещества, с которым он взаимодействует.
Одним из самых распространенных видов взаимодействия металлов является окисление, когда металл соединяется с кислородом из воздуха или из вещества, с которым происходит реакция. Например, железо при окислении образует ржавчину – оксид железа. Взаимодействие металлов с кислородом приводит к образованию оксидов металлов.
Кроме того, металлы могут вступать в реакцию с кислотами. Например, реакция цинка с серной кислотой приводит к образованию соли цинка и выделению водорода. При этом металл замещает водород в кислоте, что можно записать в виде уравнения реакции. Аналогичным образом металлы могут вступать в реакцию с другими кислотами, например, соляной или азотной.
Однако металлы также могут взаимодействовать и с щелочными растворами, образуя соли металлов. Например, при взаимодействии натрия с водой образуется сода – гидроксид натрия. Такие реакции происходят при контакте металла с водной средой и приводят к образованию гидроксидов.
И наконец, некоторые металлы могут взаимодействовать с неорганическими соединениями, такими как соли металлов. Например, при взаимодействии цинка с раствором сернокислого раствора наблюдается выделение серного газа и образование соли цинка. Подобные реакции можно использовать для получения различных соединений металлов.
Физико-химические свойства металлов

Металлы - это элементы, которые обладают определенными физико-химическими свойствами. Одним из основных свойств металлов является их способность проводить тепло и электричество. Это объясняется наличием свободных электронов в кристаллической решетке металлов.
Кроме того, металлы обладают высокой пластичностью и проводимостью. Они способны быть раскатанными, протянутыми в проволоку или вытянутыми в тонкие листы. Это свойство делает металлы идеальными материалами для различных промышленных процессов.
Однако металлы также подвержены коррозии, то есть окислению при контакте с воздухом или другими химическими веществами. Для защиты металлов от коррозии применяют различные методы, включая покрытие их защитными слоями или использование антикоррозионных средств.
Еще одним важным свойством металлов является их реактивность. Металлы активно взаимодействуют с кислотами, щелочами и другими химическими веществами. Реакции металлов с кислотами проявляются в образовании солей и выделении водорода.
Стоит также отметить, что металлы могут образовывать сплавы и легированные материалы, имеющие улучшенные свойства. Сплавы металлов используются в различных отраслях промышленности, таких как авиация, судостроение и электроника.
Практическое применение химических свойств металлов

Химические свойства металлов позволяют широко использовать их во многих отраслях промышленности и научных исследованиях. Например, железо, один из самых распространенных металлов, используется для производства стальных конструкций, автомобилей, бытовой и строительной техники.
Алюминий, благодаря своей легкости и хорошей коррозионной стойкости, применяется в авиационной и автомобильной промышленности, а также в производстве упаковочных материалов и техники.
Ртуть и свинец использовались в прошлом в производстве термометров и аккумуляторов, но из-за их высокой токсичности и вредного воздействия на здоровье, они стали постепенно замещаться безопасными аналогами.
Медь применяется в электротехнике из-за своей высокой электропроводности, а золото и серебро используются для изготовления ювелирных изделий, электроники и в медицинских целях.
Кальций и магний широко применяются в производстве строительных материалов и добавок к пище, так как обладают особыми физиологическими свойствами и являются необходимыми элементами для организма человека.
В области научных исследований металлы используются для проведения экспериментов и получения новых материалов с определенными свойствами. Например, титан применяется в аэрокосмической промышленности из-за своей легкости, прочности и устойчивости к коррозии.
Разнообразие химических свойств металлов
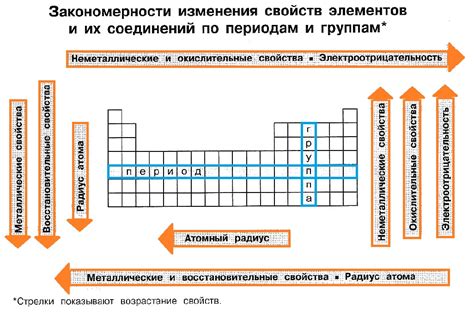
Металлы являются одной из основных групп химических элементов и отличаются своей химической активностью и разнообразием свойств. Реактивность металлов определяется их способностью образовывать химические соединения с другими веществами.
Одним из основных химических свойств металлов является их способность к окислению, то есть к передаче электронов на другие химические вещества. Этот процесс называется реакцией окисления. В результате окисления металл образует положительные ионы, которые вступают в химическую реакцию с отрицательными ионами других веществ.
Металлы также проявляют разнообразие своих химических свойств в реакциях с кислотами и основаниями. Взаимодействие металлических и соляных кислот приводит к образованию солей и выделению водорода. Как правило, реакция металла с кислотой сопровождается образованием пузырей газа.
Металлы также обладают способностью реагировать с неметаллическими элементами, например, с кислородом или с халогенами. При этом возникают химические соединения, такие как оксиды или соли хлора, которые могут иметь различные свойства и применения.
Способность металлов проявлять разнообразные химические свойства основана на их структуре и электронной конфигурации. Металлы, обладающие малым количеством электронов во внешней оболочке, имеют большую активность и склонность к реакциям.
Таким образом, разнообразие химических свойств металлов позволяет им находить широкое применение в различных областях, начиная от строительства и производства металлических конструкций, заканчивая использованием в процессе химических реакций и производстве различных продуктов.
Вопрос-ответ

Какие химические свойства металлов можно описать с помощью уравнений?
Уравнения позволяют описывать реакции металлов с кислородом, кислотами, водой, щелочами, солями и другими веществами. Например, можно записать уравнение реакции металла с кислородом, при котором образуется оксид металла. Также, с помощью уравнений можно описывать реакции металлов между собой, образование сплавов и другие химические процессы.
Какую информацию можно получить из уравнений химических реакций металлов?
Из уравнений химических реакций металлов можно получить информацию о составе реагентов и продуктов, стехиометрии реакции, изменении окислительно-восстановительного потенциала металла, скорости реакции и другие параметры. Также, на основе уравнений можно рассчитать количество веществ, необходимое для проведения реакции или оценивать выход продуктов.
В чем заключается химическая реакция образования сплавов металлов?
Химическая реакция образования сплавов металлов происходит при смешении двух или более металлов. В результате такой реакции происходит взаимодействие атомов металлов, что приводит к образованию нового вещества - сплава. Уравнение реакции образования сплава позволяет описать состав сплава и количество веществ, необходимых для его получения.
Можно ли с помощью уравнений описать реакцию между металлом и кислотой?
Да, с помощью уравнений можно описать реакцию между металлом и кислотой. В результате такой реакции образуется соль и выделяется водород. Уравнение реакции между металлом и кислотой позволяет описать состав реагентов и продуктов, количество веществ, участвующих в реакции, а также рассчитать выход продуктов реакции.
