Вода является химическим соединением, которое имеет особую реактивность с различными веществами. Особый интерес вызывает взаимодействие воды с активными металлами. Активные металлы вступают в химическую реакцию с водой, что приводит к образованию гидроксидов и выделению водорода. Данная реакция имеет важное промышленное и научное значение.
Активные металлы, такие как натрий (Na), калий (K) и литий (Li), обладают низкой электроотрицательностью и высокой реактивностью. При контакте с водой, эти металлы реагируют, образуя оксид металла и гидроксид. Реакция происходит с выделением большого количества энергии и образованием характерного шипящего звука. Это свидетельствует о быстром разложении воды, начинаясь с момента, когда металл вступает в контакт с водой.
Процесс взаимодействия активных металлов с водой основывается на способности металлов отдавать электроны. Вода, в свою очередь, действует как окислитель, поглощая эти электроны и выделяя водород. Этот процесс называется гидролизом. В результате гидролиза образуются гидроксид и ион водорода, которые остаются в растворе.
Реактивность воды с активными металлами открывает широкие перспективы применения этих металлов в различных областях науки и промышленности. Например, активные металлы используются в качестве реагентов при проведении различных экспериментов и реакций в лаборатории. Они также находят применение в процессах получения водорода, который может быть использован как энергетический ресурс или для производства различных химических соединений.
Реактивность воды с активными металлами имеет не только полезное применение, но и может представлять опасность при неправильном обращении с этими веществами. Взаимодействие активных металлов с водой может привести к разрушению контейнеров и образованию взрывоопасных смесей. Поэтому необходимо соблюдать особые меры предосторожности при обращении с активными металлами и аккуратно проводить эксперименты с ними.
Возможности реактивности воды с активными металлами

Вода – это важное и универсальное реагентное вещество, способное взаимодействовать с различными материалами, включая активные металлы. Такие металлы, как натрий, калий, литий, магний, реагируют с водой, образуя гидроксиды и выделяяся водород.
Реактивность воды с активными металлами определяется их электрохимическим потенциалом, который позволяет активным металлам легко передавать электроны и взаимодействовать с водой. При взаимодействии активного металла с водой происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а вода восстанавливается.
Процесс реакции активных металлов с водой можно описать следующим образом: активный металл и вода вступают в контакт, причем вода действует как электролит и разлагается на положительный и отрицательный ионы. Активный металл сначала окисляется, отдавая электроны, которые переносятся на гидроксидные ионы. В результате окисления металла и восстановления воды образуются гидроксид и выделяется водород.
Взаимодействие воды с активными металлами имеет практическое применение. Например, натрий и калий применяются в пиротехнике для получения гидроксидов, которые служат основой для создания различных красителей и завихрений в пиротехнических изделиях. Кроме того, активные металлы используются в химической промышленности, в процессах получения аммиака, водорода и других веществ.
Взаимодействие воды с щелочными металлами

Вода активно взаимодействует с щелочными металлами, такими как натрий, калий и литий. Это реактивность обусловлена строением атома и электрохимическими свойствами этих элементов.
При контакте с водой, металлы очень быстро реагируют, образуя щелочное гидроксидное вещество и выделяя водород. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O → 2NaOH + H2
При этой реакции натрий окисляет воду, отдавая электроны и образуя щелочную соль. Водород выделяется в виде газа.
Калий и литий взаимодействуют с водой аналогично. Однако, реакция с калием протекает более активно, а с литием – менее интенсивно. По сравнению с ними натрий является наиболее реакционным металлом.
Взаимодействие воды с щелочными металлами широко применяется в химических лабораториях и промышленности. Например, натрий используется в процессах получения энергии в щелочных гальванических элементах и водородных топливных элементах.
Таким образом, реактивность воды с щелочными металлами приводит к образованию гидроксидов и выделению водорода. Это явление обусловлено особенностями строения атомов металлов и их электрохимическими свойствами.
Воздействие воды на щелочноземельные металлы

Вода обладает реактивностью и способна вступать в химическую реакцию с различными веществами, включая металлы. Щелочноземельные металлы - это элементы, которые относятся ко II группе периодической системы, такие как магний, кальций, стронций и барий.
Воздействие воды на щелочноземельные металлы может проявляться в различных реакциях. Например, сильное воздействие воды на металл магния приводит к его горению, формируя оксид магния и образуя горючий газ - водород.
С водой также взаимодействуют металлы кальция, стронция и бария. В результате этого взаимодействия образуется гидроксид металла, который может быть растворимым или нерастворимым в воде. Например, гидроксид кальция, известный также как некипящая известь, плохо растворим в воде и может выпадать в виде осадка.
Вода может также вызывать коррозию щелочноземельных металлов. В результате этого процесса на поверхности металла образуется оксид или гидроксид металла. Коррозия может приводить к повреждениям металлических конструкций и инструментов.
В целом, воздействие воды на щелочноземельные металлы является важным аспектом их реактивности. Это взаимодействие может приводить как к образованию новых соединений, так и к разрушению металлов. Понимание этих процессов позволяет использовать эти металлы для различных практических целей, а также предотвращать возможные негативные последствия их взаимодействия с водой.
Реакция воды с металлами пониженной активности

Металлы пониженной активности характеризуются меньшей способностью взаимодействовать с водой по сравнению с активными металлами. В результате этого их реакция с водой происходит медленнее и менее интенсивно.
Примером металла пониженной активности является железо. Реакция железа с водой протекает очень медленно, особенно при комнатной температуре. Даже при нагревании воды, реакция железа с водой продолжается медленно и не происходит самопроизвольно.
Реакция воды с алюминием, также относящимся к металлам пониженной активности, также происходит довольно медленно. В результате этой реакции образуется гидроксид алюминия Al(OH)3, который образует защитную пленку на поверхности алюминия и препятствует дальнейшему взаимодействию металла с водой.
Бериллий, хотя и является металлом, также относится к металлам пониженной активности. У него очень слабая способность образовывать гидроксид в реакции с водой. Поэтому реакция бериллия с водой происходит крайне медленно и даже в некоторых случаях может идти только при нагревании.
Следует отметить, что металлы пониженной активности не растворяются в воде и в отличие от активных металлов не образуют ионов, способных образовывать электролитическое растворение. Это связано с их низкой реактивностью и меньшим уровнем взаимодействия с водой.
Водородное окисление и окисление воды
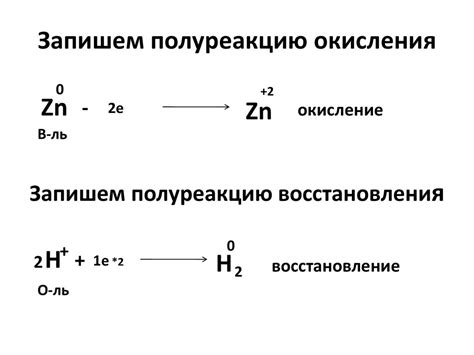
Взаимодействие активных металлов с водой может привести к водородному окислению и окислению воды. Водородное окисление — это реакция активного металла с водой, в результате которой образуется водородный газ. Эта реакция является редокс-реакцией, в которой металл отдает электроны, а вода принимает их. При этом происходит разрушение молекулы воды на ионы водорода и гидроксида, а ионы металла переходят в раствор.
Окисление воды – это реакция, при которой вода окисляется, т.е. теряет электроны, и образуются ионы кислорода. Однако окисление воды не является самостоятельной реакцией и происходит только при наличии катализаторов, таких как активные металлы или ферменты, которые способствуют прохождению этой реакции.
Водородное окисление и окисление воды имеют важное значение во многих процессах, включая производство водорода для использования в топливных элементах или в химической промышленности. Кроме того, эти реакции играют важную роль в биологических системах, например, в процессе фотосинтеза, где окисление воды приводит к образованию кислорода.
Таблица:
| Реакция | Уравнение |
|---|---|
| Водородное окисление лития | 2Li + 2H2O → 2LiOH + H2 |
| Окисление воды под действием катализатора | 2H2O → O2 + 4H+ + 4e- |
Использование активных металлов во взаимодействии с водой позволяет проводить эти процессы эффективно и контролируемо, что способствует развитию различных технологий и приложений в разных областях.
Водная реакция с переходными металлами

Переходные металлы представляют особый класс элементов, которые обладают способностью образовывать несколько валентностей. Вода реагирует с переходными металлами и образует различные осадки и соединения с разной степенью окисления.
Некоторые переходные металлы, такие как железо, медь, никель и цинк, реагируют непосредственно с водой, освобождая водородный газ. Реакции между водой и переходными металлами могут быть спонтанными, особенно если металл находится в более высокой валентности.
Вода может также реагировать с переходными металлами через ионные реакции. Например, растворы металлов в нелетучих кислотах, таких как соляная кислота, могут образовывать гидроксиды. Эти гидроксиды затем диссоциируются в воду и образуют оксид гидраты.
Переходные металлы также могут образовывать комплексные соединения с водой. Эти соединения обычно являются стабильными и могут образоваться при растворении металлов в воде или добавлении их солей в воду. Комплексные соединения могут иметь различные возможности окисления и обладать разной степенью стабильности в зависимости от изначальной валентности металла и наличия координационных соединений с другими атомами.
Влияние воды на щелочно-земельные металлы
Вода является средой, в которой происходят различные химические реакции. Щелочно-земельные металлы, такие как литий, натрий, калий, магний, кальций, стронций и барий, не являются исключением. Они имеют способность взаимодействовать с водой и проявлять свою реактивность.
Вода реагирует с щелочно-земельными металлами, образуя гидроксиды и высвобождая водород. Реакция обычно протекает более интенсивно с металлами в группе 1 периодической системы, такими как литий и натрий. При взаимодействии с водой они образуют щелочные растворы, что объясняется их высокой активностью.
Магний и другие щелочно-земельные металлы из группы 2 периодической системы также реагируют с водой, однако их активность ниже. В этом случае ионные реакции играют более важную роль, образуя гидроксиды металлов и высвобождая водород.
Реакция щелочно-земельных металлов с водой протекает быстро и сопровождается выделением тепла и газообразных продуктов. Например, при реакции лития с водой образуется гидроксид лития и выделяется водород, что делает эту реакцию спонтанной и взрывоопасной, особенно в присутствии кислорода. Барий и стронций менее активны, поэтому их реакция с водой медленнее и менее интенсивна.
Вывод: реакция воды с щелочно-земельными металлами зависит от их положения в периодической системе. Литий и натрий проявляют высокую реактивность и образуют щелочные растворы. Магний и другие металлы из группы 2 реагируют медленнее и образуют гидроксиды. Реакция воды с этими металлами сопровождается выделением тепла и газообразных продуктов.
Восстановление воды активными металлами
Вода является химическим соединением, состоящим из атомов водорода и кислорода. Однако, под воздействием активных металлов, таких как натрий или калий, происходит восстановление воды. В результате этой реакции образуются гидроксиды металлов и выделяется водородный газ.
Восстановление воды активными металлами является химической реакцией, которая протекает с выделением тепла. При этом вода вступает во взаимодействие с поверхностью активного металла, что вызывает выделение энергии. Такая реакция может протекать как с данными металлами в чистом виде, так и с их сплавами.
Процесс восстановления воды активными металлами имеет практическое применение. Например, он используется в производстве гидрогенаторов, где активные металлы играют роль катализаторов. Также, восстановление воды активными металлами может быть использовано для получения водородного газа, который находит применение в различных индустриальных процессах.
Реактивность воды с активными металлами регулируется различными условиями. Например, температура воды, концентрация раствора, а также наличие кислорода в воде. Активные металлы обладают высокой реактивностью, что может приводить к опасным последствиям. Поэтому при работе с активными металлами и водой необходимо соблюдать меры предосторожности и правила безопасности.
Вопрос-ответ

Какие активные металлы реагируют с водой?
Самыми активными металлами, реагирующими с водой, являются щелочные и щелочноземельные металлы, такие как натрий, калий, литий, магний и кальций. Они быстро реагируют с водой, образуя гидроксид металла и высвобождая водород.
Как происходит реакция активных металлов с водой?
Реакция активных металлов с водой происходит следующим образом: металл вступает в контакт с водой, растворяется в воде и образует основание (гидроксид металла) и высвобождает водород. Процесс сопровождается выделением энергии и возгоранием водорода.
Почему активные металлы реагируют с водой?
Активные металлы, такие как натрий и калий, имеют низкую ионизационную энергию, поэтому они легко отделяют электроны и образуют положительные ионы. Вода содержит отрицательно заряженные ионы гидроксила (OH-) и положительно заряженные ионы металла. Когда активные металлы вступают в контакт с водой, ионы металла реагируют с ионами гидроксила, образуя гидроксид металла и высвобождая водород.
Какая опасность может быть при реакции активных металлов с водой?
Реакция активных металлов с водой может быть опасной из-за высвобождения водорода, который может образовать взрывоопасные смеси с воздухом. Кроме того, в ходе реакции может происходить выделение большого количества тепла, что может привести к возгоранию. Поэтому реакцию активных металлов с водой следует проводить с осторожностью, соблюдая все меры предосторожности.
