Соли являются основными компонентами многих химических соединений и имеют широкое применение в различных областях науки и промышленности. Изучение их взаимодействия с другими веществами позволяет понять их химические свойства и использовать эти знания в практике.
Взаимодействие солей с металлами - одна из наиболее изученных областей химии. Многие соли обладают способностью образовывать комплексные соединения с различными металлами. Эти соединения могут иметь разную степень стабильности и использоваться в качестве катализаторов, пигментов, лекарственных препаратов и других целей. Некоторые соли могут активно реагировать с металлом, образуя новые соединения или проявляя окислительные или восстановительные свойства.
Кислоты и щелочи также оказывают влияние на соли. Многие соли растворяются в воде, образуя ионы, которые взаимодействуют с протонами в кислотах или гидроксидными ионами в щелочах. Это можно наблюдать в простом эксперименте, где при добавлении кислоты или щелочи к раствору соли происходит изменение его pH значения и образуется новое соединение или осаждаются нерастворимые соединения.
Взаимодействие солей с другими солями тоже является важной областью изучения. Некоторые соли могут растворяться или реагировать друг с другом, образуя новые соединения или изменяя свои физические или химические свойства. Это может происходить при смешивании растворов или при нагревании смеси солей до определенной температуры. Такие реакции имеют большое значение в химической промышленности, сельском хозяйстве и других отраслях.
Химические свойства солей
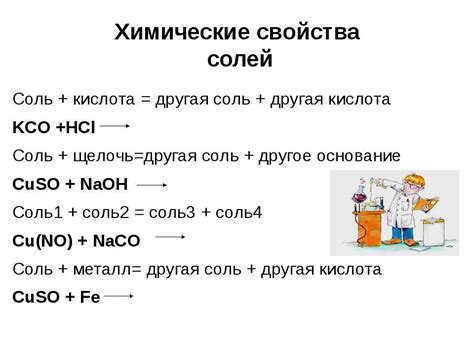
Соли являются результатом химической реакции между кислотами и основаниями. Они обладают рядом характерных свойств, которые определяют их способность взаимодействовать с другими веществами.
Растворимость в воде: Множество солей растворяется в воде, образуя ионные растворы. Растворимость зависит от природы ионов, составляющих соль, а также от температуры. Некоторые соли растворяются хорошо, образуя прозрачные растворы, в то время как другие имеют низкую растворимость и могут выпадать в осадок.
Образование отложений: Если концентрация солей в растворе становится слишком высокой, они могут выпадать в виде осадка на поверхности или внутри сосуда. Это особенно заметно в случаях, когда вода испаряется, и в растворе остаются только соли.
Взаимодействие с металлами: Некоторые соли могут реагировать с металлами, вызывая окислительно-восстановительные реакции. Например, хлорид натрия (NaCl) может действовать на алюминий, образуя газовые пузыри в результате выделения водорода.
Реакции с кислотами: Соли реагируют с кислотами, образуя новые соединения. Например, карбонат кальция (CaCO3) реагирует с соляной кислотой (HCl), образуя соль хлорида кальция (CaCl2), углекислый газ (CO2) и воду (H2O).
Взаимодействие с щелочами: Соли также могут реагировать с щелочами, образуя новые соединения. Например, сернокислый натрий (Na2SO4) может реагировать с гидроксидом кальция (Ca(OH)2), образуя гидросульфат кальция (Ca(HSO4)2) и гидроксид натрия (NaOH).
Взаимодействие с другими солями: Соли также могут взаимодействовать друг с другом, образуя новые соединения. Например, нитрат серебра (AgNO3) может реагировать с хлоридом натрия (NaCl), образуя нитрат натрия (NaNO3) и хлорид серебра (AgCl).
Химические свойства солей определяют их возможные применения в различных областях, включая пищевую промышленность, фармацевтику, металлургию, сельское хозяйство и другие.
Взаимодействие солей с металлами

Соли - это химические соединения, состоящие из катиона металла и аниона. Взаимодействие солей с металлами может протекать по разным механизмам и имеет широкий химический спектр.
Одним из основных способов взаимодействия солей с металлами является образование комплексных соединений. Комплексы могут быть как одно-, так и многоядрными, в зависимости от числа координационных связей, которые образуют металл и анион соли.
Другим механизмом взаимодействия солей с металлами является реакция обмена. В этом случае ионы металла из соли обмениваются с ионами другого металла, который находится в растворе в виде соли или внесен в реакционную среду в виде металла.
Взаимодействие солей с металлами может приводить к образованию осадков. Например, при введении нерастворимой соли в раствор, содержащий металл, может произойти реакция образования осадка. Это явление может быть использовано для очистки воды от тяжелых металлов или для получения нерастворимых соединений.
Исследование взаимодействия солей с металлами является важной областью химии и позволяет не только понять основные принципы химических реакций, но и использовать их в практических целях, например, в производстве лекарственных препаратов или материалов с особыми свойствами.
Реакции солей с кислотами

Соли и кислоты, входящие в состав них, могут образовывать разнообразные химические реакции.
Когда соль вступает в контакт с кислотой, происходит образование соответствующего соляного кислотного раствора.
Реакции солей с кислотами могут протекать с выделением газов. Например, реакция соли хлористого железа(III) с соляной кислотой приводит к выделению газа хлора:
- FeCl3 + HCl → FeCl2 + Cl2 + H2O
Реакции солей с кислотами также могут сопровождаться образованием осадка. Например, реакция сульфата меди(II) с серной кислотой приводит к образованию осадка серного купороса:
- CuSO4 + H2SO4 → CuSO4∙5H2O
Также соли могут взаимодействовать с кислотами, образуя соответствующие кислотные соли. Например, реакция хлорида натрия с серной кислотой приводит к образованию сульфата натрия:
- NaCl + H2SO4 → NaHSO4
Реакции солей с кислотами всегда сопровождаются изменением pH раствора и образованием новых соединений. Поэтому эти реакции являются важным объектом изучения в химии.
Взаимодействие солей с щелочами
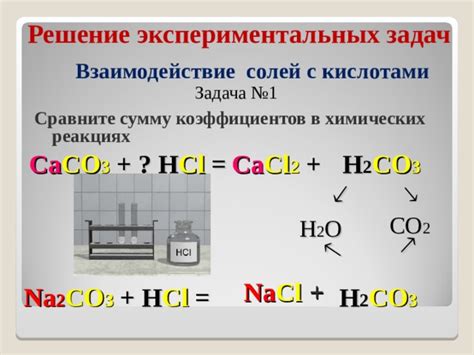
Щелочные растворы, такие как гидроксиды щелочных металлов (например, натрия, калия, лития), вступают в реакцию с солями, образуя осадок или раствор. Процесс этого взаимодействия называется осаждением или проседанием соли.
Взаимодействие солей с щелочами зависит от ионной составляющей соли. Если соль содержит катион, который обладает меньшей активностью, чем ион гидроксида в щелочи, то будет происходить осаждение. Например, взаимодействие хлорида натрия с гидроксидом калия приведет к образованию осадка хлорида калия.
Осадок может быть в различных формах, например, в виде кристаллов, порошка или нерастворимой массы. В некоторых случаях образуется растворимая соль, которая не даёт заметного осадка.
Взаимодействие солей с щелочами может также приводить к образованию новых соединений, например, гидроксосолей. Гидроксосоль образуется при взаимодействии соли с избытком щелочи, и она может иметь различные степени гидратации.
Взаимодействие солей с щелочами является важным процессом в химической промышленности и научных исследованиях. Оно может быть использовано для получения осадков с определенными свойствами, разделения и очистки смесей и исследования химических реакций.
Химические реакции между солями

Соли – это химические соединения, которые образуются при реакциях между кислотами и основаниями. В химии соли классифицируются по типу кислоты и основания, из которых они образованы. При взаимодействии соляного раствора с другой солью могут происходить различные химические реакции.
Одной из таких реакций является образование новой соли при взаимодействии двух солей. В результате реакции происходит обмен ионами между солями, что приводит к образованию нового соединения. Например, при смешивании растворов хлорида натрия (NaCl) и сульфата меди (CuSO4) образуется осадок голубого цвета, который представляет собой соль купрат(II) натрия (Na2CuSO4).
Реакция между солями может протекать и с образованием новых соединений, и с образованием осадка. Например, при смешивании растворов хлорида натрия (NaCl) и нитрата серебра (AgNO3) образуется осадок белого цвета, представляющий собой соль хлорида серебра (AgCl). Эта реакция широко используется для определения наличия хлоридов в растворах.
Описанные примеры химических реакций между солями демонстрируют, что взаимодействие солей может приводить к образованию новых соединений или образованию осадка. Понимание этих реакций играет важную роль в химии, так как позволяет предсказывать результаты различных химических процессов и эффективно использовать соли в различных областях промышленности и научных исследований.
Вопрос-ответ

Как взаимодействуют соли с металлами?
Соли могут взаимодействовать с металлами путем образования ионов и окисления металла. Например, цинковая соль может реагировать с медью, образуя растворимую соль меди и осаждая цинк.
Какие виды реакций происходят между солями и кислотами?
Когда соль добавляется к кислоте, происходит реакция нейтрализации, при которой соль растворяется и образуется вода. Например, реакция между хлоридом натрия и соляной кислотой приводит к образованию хлорида водорода и хлорида натрия.
Как осуществляется взаимодействие солей с щелочами?
Когда соль взаимодействует с щелочью, происходит реакция нейтрализации, в результате которой образуется вода и раствор соли. Например, реакция между хлоридом натрия и гидроксидом натрия приводит к образованию гидроксида натрия и хлорида натрия.
Каковы химические свойства солей при взаимодействии с другими солями?
Взаимодействие солей с другими солями может привести к образованию растворимых или нерастворимых соединений. Это может быть осаждение соли или образование новой соли. Например, реакция между хлоридом натрия и хлоридом серебра приводит к образованию осадка хлорида серебра и раствора хлорида натрия.
Можно ли сказать, что соли обладают одними и теми же химическими свойствами при взаимодействии с металлами, кислотами, щелочами и другими солями?
Химические свойства солей при взаимодействии с металлами, кислотами, щелочами и другими солями могут различаться. Зависит от типа соли и условий реакции. Некоторые соли могут образовывать осадки при взаимодействии с определенными металлами или другими солями, в то время как другие соли могут быть растворимыми и не образовывать осадков.
