Щелочноземельные металлы – это элементы, которые находятся во второй группе периодической системы, сразу после щелочных металлов. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы проявляют множество интересных химических свойств, особенно в контексте их солей.
Соли щелочноземельных металлов обладают рядом уникальных химических свойств, которые варьируются в зависимости от конкретного элемента и состава соли. Они обладают высокой растворимостью в воде и образуют кристаллические структуры, что делает их удобными для использования в различных областях, включая промышленность, медицину и сельское хозяйство.
Соли щелочноземельных металлов отличаются своими химическими реакциями. Например, бериллий образует бесцветные соли, которые обладают высокими термическими и электроизолирующими свойствами. Магнийовые соли, напротив, обладают хорошей растворимостью и используются в производстве огнетушителей и лекарств. Кальцийовые соли широко используются в строительстве и в качестве пищевых добавок, а стронциевые соли применяются в фармацевтической промышленности и радиоактивных технологиях.
Химические свойства солей щелочноземельных металлов позволяют им быть полезными и важными соединениями, играющими ключевую роль в различных областях нашей жизни.
Свойства солей щелочноземельных металлов
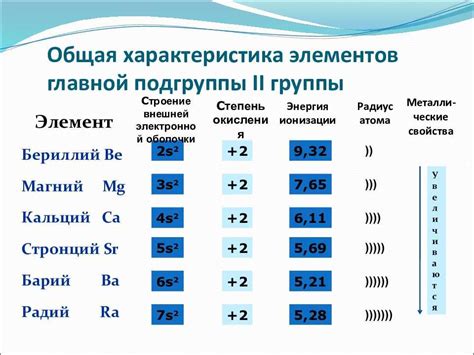
Щелочноземельные металлы – это элементы II группы периодической системы Менделеева, включающие в себя бериллий, магний, кальций, стронций, барий и радий. Они имеют схожие химические свойства и образуют соли, которые обладают определенными особенностями.
Соли щелочноземельных металлов обычно имеют кристаллическую структуру и хорошую растворимость в воде. В растворе они могут образовывать ионы, которые являются основой для многих химических реакций. Бериллий и его соли имеют высокую токсичность, а радий является радиоактивным элементом, что делает его соли опасными для здоровья.
Соли щелочноземельных металлов обладают рядом химических свойств. Они обычно образуют растворы, которые обладают щелочными свойствами, то есть изменяют кислотно-щелочной баланс. Большинство щелочноземельных солей хорошо растворимы в воде и образуют прозрачные растворы. Они обладают высокой электропроводностью.
Еще одним химическим свойством солей щелочноземельных металлов является их способность образовывать осадки. При взаимодействии с некоторыми растворами, например, с растворами некоторых кислот или оснований, соли могут выпадать в виде осадка. Это может быть использовано в лаборатории для выделения и очистки солей.
Также следует отметить, что некоторые соли щелочноземельных металлов могут быть использованы в различных промышленных процессах. Например, сульфаты и хлориды бария применяются для производства белых пигментов и сушки лаков. Карбиды и оксиды кальция используются в производстве сплавов и строительных материалов.
Физические свойства

Соли щелочноземельных металлов обладают рядом характерных физических свойств. Во-первых, они обычно являются твердыми веществами с кристаллической структурой. Кристаллическая сетка солей щелочноземельных металлов обладает высокой степенью упорядоченности, что делает их кристаллы блестящими и прозрачными.
Во-вторых, соли щелочноземельных металлов имеют высокую плотность. Обычно они плотнее воды и могут легко тонуть в ней. Также они обладают высокой температурой плавления и кипения из-за крепких связей внутри кристаллической решетки.
Соли щелочноземельных металлов обычно обладают хрупкостью и легко разламываются на кристаллы. Они могут быть прозрачными или иметь различные оттенки цвета в зависимости от наличия примесей или степени окисления металла.
Особенностью солей щелочноземельных металлов является их растворимость в воде. Они образуют гидратированные ионы в водных растворах, что влияет на их физические свойства. Некоторые соли щелочноземельных металлов обладают также свойствами понижать температуру замерзания воды и увеличивать ее поверхностное натяжение.
Химические свойства

Щелочноземельные металлы образуют стабильные соли, которые обладают рядом химических свойств. Они обладают высокими температурами плавления и кипения, что делает их подходящими для использования в различных высокотемпературных процессах.
Соли щелочноземельных металлов хорошо растворяются в воде, образуя растворы, которые могут иметь щелочную реакцию. Это связано с тем, что при растворении солей щелочноземельных металлов образуются ионные соединения, которые способны протекать реакции с водой.
Взаимодействие солей щелочноземельных металлов с кислотами приводит к образованию солей и осаждению соответствующих кислот. Также возможно взаимодействие солей с другими соединениями, например, с образованием двойных солей.
Важным свойством солей щелочноземельных металлов является их способность образовывать комплексные соединения. Это связано с наличием свободных d-орбиталей у ионов щелочноземельных металлов, что позволяет им вступать в сложные координационные связи.
Роль в жизни организмов

Соли щелочноземельных металлов играют важную роль в жизни организмов. Они являются необходимыми микроэлементами, без которых нормальное функционирование организма невозможно.
В частности, соли кальция являются строительным материалом для костей и зубов. Кроме того, кальций участвует в процессе свертывания крови, а также в проведении нервных импульсов в организме.
Соли магния влияют на сократительную способность мышц и обеспечивают нормальное функционирование нервной системы. Магний также активно участвует в обмене веществ и синтезе белков.
Соли бария и стронция играют важную роль в формировании костей и зубов у животных. Они обладают способностью ускорять их рост и укреплять их структуру.
Кроме того, соли щелочноземельных металлов применяются в медицине для лечения различных заболеваний. Например, глинозем используется для производства препаратов, применяемых при лечении гастрита и язвы желудка. Соли кальция используются как дополнительные источники кальция для профилактики и лечения остеопороза.
Применение в промышленности

Соли щелочноземельных металлов широко используются в различных отраслях промышленности.
- Щелочноземельные металлы и их соли находят применение в изготовлении огнебезопасных материалов. Например, магниевые и кальциевые соединения используются в процессе производства огнеупорных кирпичей и керамических изделий, которые обладают высокой термостойкостью и применяются в строительной и металлургической промышленности.
- Соли щелочноземельных металлов находят применение как катализаторы в различных процессах химического производства. Например, оксиды кальция и магния могут использоваться в качестве катализаторов при производстве пластмасс, резиновых изделий и жиров.
- Магниевые соли широко используются в производстве удобрений. Магний является важным микроэлементом для растений, и его соли помогают улучшить питательный состав почвы и повысить урожайность.
- Карбонаты щелочноземельных металлов, такие как кальций и магний, применяются в пищевой промышленности в качестве пищевых добавок. Они используются как стабилизаторы, регуляторы кислотности, антиоксиданты и улучшители текстуры в различных продуктах питания.
- Магниевые и кальциевые соединения находят применение в производстве лекарственных препаратов. Кальций и магний являются важными микроэлементами для организма человека, и их соли используются в составе многих лекарственных препаратов для профилактики и лечения различных заболеваний.
Таким образом, соли щелочноземельных металлов имеют широкое применение в промышленности, от строительства и металлургии до пищевой промышленности и фармацевтики.
Вопрос-ответ

Какие химические свойства обладают соли щелочноземельных металлов?
Соли щелочноземельных металлов обладают несколькими химическими свойствами. Во-первых, они образуют кристаллическую решетку, что влияет на их физические свойства, такие как тугоплавкость и твёрдость. Во-вторых, соли щелочноземельных металлов обладают щелочным характером, то есть они могут образовывать щелочные растворы и нейтрализовать кислоты. Кроме того, эти соли могут реагировать с другими веществами и участвовать в различных химических реакциях, таких как осаждение, окисление или восстановление.
Какие вещества могут образовывать соли щелочноземельных металлов?
Соли щелочноземельных металлов образуются в результате реакции этих металлов с кислотами. В зависимости от типа кислоты, которая участвует в реакции, образуются различные соли. Например, реакция щелочноземельного металла с соляной кислотой даст хлорид этого металла, реакция с серной кислотой - сульфат, с азотной кислотой - нитрат и т.д.
Каким образом можно использовать соли щелочноземельных металлов в повседневной жизни?
Соли щелочноземельных металлов имеют широкое применение в повседневной жизни. Например, карбонат кальция (CaCO₃), известный также как мрамор, используется в строительстве и для изготовления различных предметов интерьера. Хлорид магния (MgCl₂) применяется в медицине, а также используется для промышленных целей, например, в процессе добычи нефти. Полифосфаты кальция и магния используются в моющих средствах и стиральных порошках для смягчения воды и предотвращения образования накипи. И это только несколько примеров - соли щелочноземельных металлов находят применение во многих отраслях человеческой деятельности.
