Щелочные металлы - это элементы, расположенные в первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть общий набор свойств, но каждый из них также имеет свои уникальные характеристики.
Одним из основных свойств щелочных металлов является их высокая реактивность. Они легко вступают в химические реакции с другими веществами, особенно с кислородом и водой. При контакте с водой они могут производить горючий газ, который может воспламеняться или взрываться. Это свойство делает их опасными для хранения и обработки.
Другой важной характеристикой щелочных металлов является их способность образовывать сильные щелочные растворы. Это связано с тем, что они легко диссоциируют в ионные формы, освобождая положительные ионы, такие как Li+, Na+ и K+. Это является основой для использования щелочных металлов в различных промышленных и научных процессах.
Также щелочные металлы характеризуются низкой плотностью и низкой температурой плавления. Это делает их легкими металлами, которые можно легко обработать и использовать в различных приложениях. Некоторые из них имеют красивый блеск или характерные цвета и часто используются в украшениях и художественных изделиях.
Значение изменения свойств щелочных металлов

Щелочные металлы представляют собой группу химических элементов, которые обладают рядом уникальных свойств и важны для множества прикладных областей. Изменение свойств щелочных металлов может иметь значительное значение в различных аспектах, таких как электроника, фармацевтика, энергетика и материаловедение.
Одним из главных свойств щелочных металлов является их активность. Они обладают высокой реакционной способностью, что делает их полезными для использования в химических реакциях и синтезе органических соединений. Кроме того, щелочные металлы могут служить катализатором во многих промышленных процессах.
Другим важным свойством щелочных металлов является их низкая плотность. Они являются легкими элементами, что делает их применимыми для использования в промышленности, где вес имеет значение, например, в авиационной и автомобильной отраслях. Благодаря своей низкой плотности, щелочные металлы могут быть использованы в конструкции легких и прочных материалов.
Также стоит отметить, что щелочные металлы обладают высокой проводимостью электричества. Это позволяет использовать их в электронике, например, в производстве аккумуляторов или полупроводников. Благодаря этим свойствам, щелочные металлы стали неотъемлемой частью современных технологий и находят применение в различных устройствах, от мобильных телефонов до солнечных батарей.
В целом, изменение свойств щелочных металлов имеет огромное значение для научных и прикладных исследований. Оно открывает новые возможности в различных областях и способствует развитию новых технологий. Поэтому, изучение и понимание свойств щелочных металлов является важным заданием для ученых и инженеров, чтобы использовать их потенциал на практике.
Свойства щелочных металлов

Щелочные металлы - группа химических элементов первой группы периодической таблицы, включающая литий, натрий, калий, рубидий, цезий и франций. Эти элементы обладают рядом уникальных свойств, которые делают их очень важными для различных областей науки и промышленности.
1. Атомная структура: Щелочные металлы имеют одну электронную оболочку и легко отдают этот электрон, чтобы образовать положительный ион. Их атомы обладают простой структурой, что делает их хорошими модельными системами для изучения основных принципов химии.
2. Активность: Щелочные металлы являются очень активными элементами и легко реагируют с водой, кислородом и другими веществами. Они проявляют стремление к электронной и катионной реактивности, что делает их полезными для множества химических реакций.
3. Воспламеняемость: Щелочные металлы, такие как литий и натрий, могут воспламеняться при контакте с воздухом или водой. Это связано с их высокой реактивностью и способностью образовывать органические и неорганические соединения, которые могут быть горючими.
4. Пониженная плотность: Щелочные металлы обладают относительно низкой плотностью. Например, литий имеет плотность всего 0,53 г/см3, что делает его легче большинства других металлов. Это свойство делает их полезными во многих приложениях, включая конструкцию легких материалов и литиевые батареи.
5. Высокая электропроводность: Щелочные металлы обладают высокой электропроводностью. Из-за этого они широко используются в электрических цепях и устройствах, таких как батарейки и солевые электролиты.
6. Образование сплавов: Щелочные металлы могут образовывать сплавы с другими металлами, что делает их важными для промышленности. Например, натрий образует легкоплавкий сплав с оловом, который используется в сварочных электродах и пайке.
7. Биологическое значение: Щелочные металлы играют важную роль в жизни организмов. Натрий и калий, например, являются важными катионами, регулирующими осмотическое давление клеток, а также сигнальными и структурными компонентами.
В целом, щелочные металлы обладают уникальными свойствами, которые делают их важными для различных областей науки, технологии и медицины. Исследования и применение этих элементов помогают нам лучше понять фундаментальные принципы химии и использовать их в различных сферах нашей жизни.
Химическая активность
Химическая активность щелочных металлов (литий, натрий, калий, рубидий, цезий, франций) является высокой из-за их низкого энергетического барьера и большой реакционной способности.
Щелочные металлы легко вступают в реакцию с кислородом и водой, возгоняясь при этом. Они реагируют с кислородом алкалинового раствора воды, образуя гидроксиды. Например, натрий вступает в реакцию с водой и образует гидроксид натрия и летучий гидроген:
- 2Na + 2H2O -> 2NaOH + H2
Щелочные металлы также реагируют с галогенами (фтор, хлор, бром, йод), образуя галоиды. Например, натрий реагирует с хлором и образует хлорид натрия:
- 2Na + Cl2 -> 2NaCl
Взаимодействие щелочных металлов с кислотами также является типичным для них. Они реагируют с кислотами, образуя соответствующие соли и выделяя водород. Например, натрий и соляная кислота взаимодействуют и образуют хлорид натрия и водород:
- 2Na + 2HCl -> 2NaCl + H2
Химическая активность щелочных металлов также проявляется в их способности образовывать двойные соли и комплексы в растворах. Они образуют соли с кислотами, окислами, аммиаком и другими веществами.
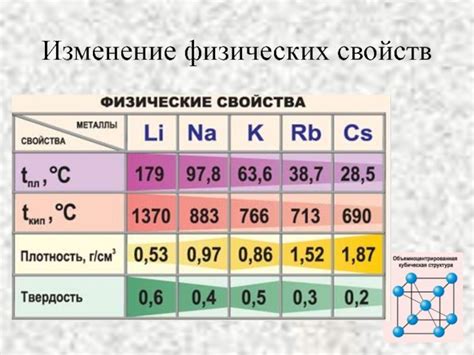
Физические свойства

Щелочные металлы обладают рядом характеристик, которые определяют их физические свойства. Вот некоторые из них:
- Точка плавления: Щелочные металлы обычно имеют низкую точку плавления, что обусловлено их слабыми межатомными связями. Например, натрий имеет точку плавления около 98 градусов Цельсия.
- Плотность: Щелочные металлы обладают низкой плотностью, что делает их легкими и подвижными. Например, калий имеет плотность около 0,86 г/см³.
- Цвет: Большинство щелочных металлов имеют характерный металлический блеск и серебристый цвет. Но при их взаимодействии с воздухом может образовываться окисленная пленка, что может изменить цвет поверхности.
- Мягкость: Щелочные металлы являются мягкими и податливыми металлами. Например, литий может быть легко нарезан ножом или даже согнут руками.
- Проводимость тепла и электричества: Щелочные металлы являются хорошими проводниками тепла и электричества благодаря свободно движущимся электронам в их структуре.
- Тугоплавкость: Некоторые щелочные металлы, такие как цезий и франций, имеют очень низкую температуру плавления, что делает их необычными и интересными в научном исследовании.
Эти характеристики позволяют щелочным металлам применяться в различных областях, таких как производство батарей, сплавов, люминесцентных веществ, средств огнезащиты и других промышленных и научных приложениях.
Плотность и точка плавления
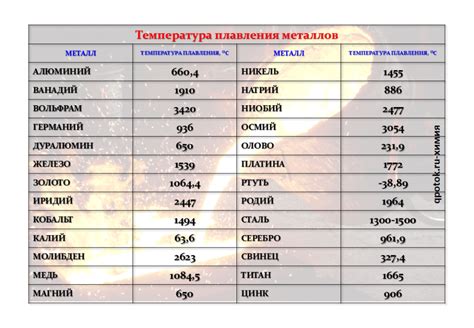
Плотность и точка плавления являются важными характеристиками щелочных металлов и отражают их физические свойства.
Плотность щелочных металлов имеет достаточно высокие значения и составляет:
- 0,86 г/см³ для лития;
- 0,97 г/см³ для натрия;
- 0,86 г/см³ для калия;
- 0,79 г/см³ для рубидия;
- 0,71 г/см³ для цезия.
Точка плавления щелочных металлов также различается:
- 650 °С для лития;
- 98 °С для натрия;
- 63 °С для калия;
- 39 °С для рубидия;
- 28 °С для цезия.
Учитывая высокую плотность и низкую точку плавления, щелочные металлы обладают хорошей текучестью и способностью плавиться при невысоких температурах. Это делает их важными компонентами в различных отраслях, включая металлургию, электронику и химическую промышленность.
Изменение свойств щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и другие, обладают рядом уникальных свойств, которые проявляются при изменении их химической структуры и физических характеристик.
Первое свойство, которое отличает щелочные металлы, это их низкая плотность. Они являются легкими элементами и обладают низкой плотностью, что делает их легкими для обработки и использования. Низкая плотность также связана с их атомной структурой, где щелочные металлы имеют большой радиус атома и небольшую массу ядра.
Второе свойство – активность щелочных металлов в реакциях с водой. Щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород. Реакция с водой происходит очень быстро и сильно, сопровождаясь выделением тепла и образованием щелочных растворов. Эта реакция является сильно щелочной, что объясняет их название.
Третье свойство – образование оксидов. Щелочные металлы могут образовывать оксиды при действии с воздухом или кислородом. Эти оксиды могут быть кислотными, щелочными или нейтральными, в зависимости от реакционных условий. Образование оксидов увеличивается с увеличением порядкового номера элемента в периодической таблице.
Четвертое свойство – способность образовывать ионы. Щелочные металлы легко теряют электрон(ы) и образуют положительные ионы. Это обусловлено их слабыми электронными оболочками и низкой электроотрицательностью. Ионный характер щелочных металлов влияет на их реакционную способность и способность участвовать в различных химических реакциях.
Выводя свои свойства за рамки обычных металлов, щелочные металлы демонстрируют уникальные химические и физические характеристики, основанные на их атомной структуре и реакционной способности. Их низкая плотность, активность в реакциях с водой, образование оксидов и способность образовывать ионы делают их важными элементами в различных отраслях промышленности и научных исследованиях.
Влияние внешних факторов

Свойства щелочных металлов, таких как литий, натрий, калий и т.д., могут изменяться под воздействием различных внешних факторов. Эти металлы обладают большой химической активностью и реакционностью, поэтому даже небольшие изменения в условиях окружающей среды могут существенно влиять на их свойства и поведение.
Влияние температуры на свойства щелочных металлов является одним из наиболее заметных. При нагревании металлы этой группы могут претерпевать фазовый переход и изменять свою структуру. Например, при достижении определенной температуры литий становится мягким металлическим материалом, который может быть легко расформован и использован в различных областях промышленности.
Влияние давления на свойства щелочных металлов также является значительным. При повышенном давлении эти металлы могут претерпевать сжатие и изменять свою плотность. Например, под действием высокого давления калий может превратиться в плотную и твердую форму, которая обладает специфическими свойствами и может использоваться в различных технологических процессах.
Кроме того, щелочные металлы чувствительны к воздействию различных химических реагентов, таких как кислоты и основания. Взаимодействие с такими веществами может привести к изменению цвета, структуры и физических свойств металлов этой группы. Например, реакция натрия с водой приводит к выделению водорода и образованию щелочной среды, что делает натрий опасным веществом при неправильном обращении.
Таким образом, внешние факторы, такие как температура, давление и химические реагенты, играют важную роль в изменении свойств щелочных металлов. Понимание этих взаимодействий позволяет использовать эти металлы в различных областях науки и техники, а также предотвращать возможные негативные последствия их применения.
Вопрос-ответ

Какие свойства щелочных металлов можно изменить?
Среди свойств щелочных металлов можно изменить такие характеристики, как плотность, температуру плавления, электропроводность, окислительные свойства и другие.
Каким образом можно изменить окислительные свойства щелочных металлов?
Окислительные свойства щелочных металлов можно изменить путем изменения их электронной конфигурации. Например, добавление электронов или удаление электронов может повлиять на степень окисления и способность металла принимать или отдавать электроны при взаимодействии с другими веществами.
Какие другие свойства щелочных металлов могут быть изменены?
Помимо окислительных свойств, можно изменить и другие свойства щелочных металлов. Например, путем добавления специальных примесей можно изменить их электропроводность или термическую стабильность. Также можно изменить их физические свойства, такие как плотность или температуру плавления. В общем, достаточно много свойств можно изменить с помощью различных методов и веществ.
