Щелочные металлы - это первая группа периодической таблицы Менделеева, включающая литий, натрий, калий, рубидий, цезий и франций. Эти металлы характеризуются высокой реактивностью и способностью образовывать соединения с различными элементами. Их химические свойства могут быть очень интересными и захватывающими, особенно когда рассматриваются в контексте видеоопытов.
Один из самых известных видеоопытов с щелочными металлами - это реакция натрия с водой. Во время этого опыта натрий активно взаимодействует с водой, выделяя значительное количество водорода и образуя гидроксид натрия. Процесс сопровождается характерным потрескиванием и извержением пламени, что делает его интересным и впечатляющим для зрителей.
Еще один увлекательный опыт, связанный с щелочными металлами, - это демонстрация реакции калия с водой. Калий, будучи более реактивным, чем натрий, взаимодействует с водой еще более ярко. В результате образуется гидроксид калия и большое количество водорода. Вспыхивающее пламя и стремительное движение калия по поверхности воды делают этот опыт по-настоящему захватывающим для зрителей.
Кроме того, у щелочных металлов есть и другие интересные химические свойства, которые можно продемонстрировать в видеоопытах. Например, при смешивании металлического калия с галогенами, такими как хлор или йод, происходят реакции, сопровождающиеся яркими цветами и выделением тепла. Такие опыты могут быть не только увлекательными, но и позволяют углубиться в изучение химии щелочных металлов.
Видеоопыты с щелочными металлами открывают перед нами удивительный мир реакций и взаимодействий. Они позволяют увидеть химические свойства этих металлов в действии и исследовать их уникальные возможности. Зрелищность и интерес таких опытов делает их популярными не только у школьников и студентов, но и у всех, кто интересуется наукой о веществе и его превращениях.
Реакция щелочных металлов с водой
Щелочные металлы, такие как литий, натрий и калий, обладают высокой реактивностью при контакте с водой. Это связано с их низкой электроотрицательностью и способностью образовывать гидроксиды. Реакция щелочных металлов с водой происходит с выделением водорода и образованием щелочного гидроксида.
При взаимодействии лития с водой возникает интенсивное пузырьковое выделение водорода. Натрий также реагирует с водой, но медленнее, образуя растворимый гидроксид. Калий реагирует с водой еще активнее, начиная тлеть и выделяться ярко-фиолетовое пламя. Имейте в виду, что реакция щелочных металлов с водой происходит с выделением большого количества тепла, поэтому обладать должными мерами предосторожности очень важно.
Рассмотрим реакцию натрия с водой подробнее. Когда кусок натрия опускается в воду, происходит вспышка света и возгорается пламя. Натрий начинает быстро двигаться по поверхности воды, причем выделение водорода сопровождается звуками хлопка. В результате реакции образуется щелочный раствор гидроксида натрия, который можно обнаружить по щелочной реакции с фенолфталеином.
Реакция щелочных металлов с водой является одной из самых зрелищных и впечатляющих демонстраций химических свойств этих элементов. Такие видеоопыты в классе или лаборатории могут вызывать интерес и удивление учащихся, а также помогать им лучше понять особенности реакций и свойства щелочных металлов.
Горение щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют способность гореть в контакте с кислородом. Горение щелочных металлов является результатом химической реакции между металлом и кислородом, при которой выделяется большое количество тепла и образуется окисленное соединение.
Процесс горения щелочных металлов происходит очень быстро и сопровождается ярким пламенем. Металлы при этом реагируют с кислородом из воздуха, образуя оксиды. Например, натрий горит с ярко-желтым пламенем, образуя оксид натрия.
Горение щелочных металлов можно наблюдать в ряде интересных видеоопытов. Например, можно показать, как натрий реагирует с водой, образуя горящие капли, или как литий горит в аргоне без доступа кислорода, образуя красивый фиолетовый огонь.
Горение щелочных металлов является свидетельством их высокой химической активности. Эти металлы имеют низкий уровень ионизационной энергии, что делает их легко воспламеняемыми. Поэтому при работе с щелочными металлами необходимо быть очень осторожным и соблюдать все меры безопасности.
Щелочные металлы в реакциях с кислотами
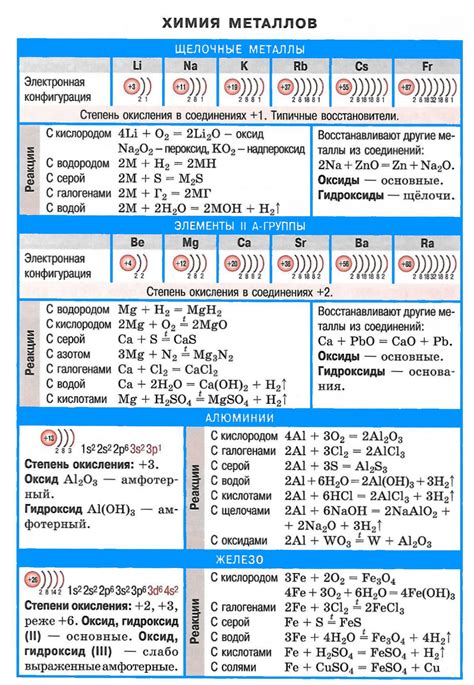
Щелочные металлы, такие как литий, натрий, калий и т. д., проявляют интересные реакции при контакте с кислотами.
При взаимодействии сильных кислот, например, соляной или серной, щелочные металлы проявляют сильную реактивность. Они активно реагируют, выделяя большое количество водорода. Эти реакции могут сопровождаться шипением и плавающим в воздухе газовым пламенем.
Реакции щелочных металлов с слабыми кислотами, такими как уксусная или лимонная кислота, проходят менее интенсивно. В этом случае выделяется меньше водорода, и реакция протекает более медленно.
Щелочные металлы могут также проявлять реактивность при взаимодействии с более сложными кислотами, например, соляным эфиром. При такой реакции образуются соли и алкогольные соединения.
В реакциях щелочных металлов с кислотами важно соблюдать меры безопасности, так как эти реакции сопровождаются выделением взрывоопасного водорода и могут привести к образованию токсичных паров или взрывам.
Взаимодействие щелочных металлов с галогенами

Щелочные металлы – это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий и цезий. Галогены – это элементы семьдесят седьмой группы периодической системы, включающие фтор, хлор, бром, йод и астат.
Взаимодействие щелочных металлов с галогенами приводит к образованию ионных соединений. Щелочные металлы передают один электрон галогенам, образуя положительно заряженные ионы, называемые катионами. Галогены, в свою очередь, получают электрон от щелочных металлов и образуют отрицательно заряженные ионы, называемые анионами.
Взаимодействие лития с фтором, например, приводит к образованию соединения LiF. В этом соединении литий отдает свой электрон галогену фтору, образуя катион Li+ и анион F-. Таким образом, нарушается баланс заряда атомов, исходные элементы становятся ионами.
Взаимодействие металлов группы щелочных металлов с галогенами происходит с выделением большого количества энергии, что является проявлением химической реакции. В результате этой реакции образуется соль – ионное соединение щелочного металла и галогена. Такие соли широко применяются во многих областях, например, в медицине, на промышленных производствах и в быту.
Вопрос-ответ

Чем характеризуются химические свойства щелочных металлов?
Щелочные металлы характеризуются высокой реактивностью и активностью, поскольку их атомы обладают единственной валентностью. Они активно взаимодействуют с водой, кислородом, горючими веществами и другими элементами.
Какие реакции происходят между щелочными металлами и водой?
При взаимодействии щелочных металлов с водой образуется щелочная растворимая основа и выделяется водород. Например, натрий (Na) взаимодействует с водой по следующему уравнению: 2Na + 2H2O → 2NaOH + H2↑. Этот процесс называется гидролизом.
Какую реакцию можно показать в видеоопыте с щелочными металлами?
Один из популярных видеоопытов с щелочными металлами - это реакция натрия с водой. При ее проведении можно наблюдать, как маленький кусочек натрия активно реагирует с водой, и в результате выделяется водород и образуется растворимая соль NaOH.
Как влияют щелочные металлы на фламинго?
Фламинго имеет ярко-красный цвет благодаря наличию пигмента каротина, который он получает из пищи, в основном из планктона. Однако иногда фламинго съедает водородный сульфид (H2S), который может содержаться в грязной или загрязненной воде. Вода с водородным сульфидом имеет щелочную среду, и щелочные металлы, такие как натрий, могут изменять pH воды. Изменение pH воды может приводить к изменению цвета пигмента каротина в организме фламинго, что делает перья птицы более яркими и насыщенными.
