Щелочные металлы - это элементы периодической системы, входящие в первую группу. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы характеризуются рядом уникальных химических свойств, особенно взаимодействием с солями.
Солями называют соединения, которые образуются при реакции щелочных металлов с кислотами. В результате этой реакции образуется соль и выделяется вода. Эта реакция называется нейтрализацией и является одной из основных химических реакций.
Щелочные металлы хорошо растворяются в воде, поэтому реакция между ними и солями происходит в водной среде. При этом происходит образование ионов металла и анионов из соли. Эта реакция сопровождается выделением тепла и изменением цвета раствора. Таким образом, щелочные металлы с солями образуют новые соединения, которые имеют свои характеристические свойства.
Щелочные металлы с солями имеют широкое применение в различных областях, таких как фармацевтика, пищевая промышленность, производство удобрений и другие. Их свойства позволяют использовать их в качестве катализаторов для различных реакций, а также в процессах очистки воды от вредных примесей.
Изучение химических свойств щелочных металлов с солями
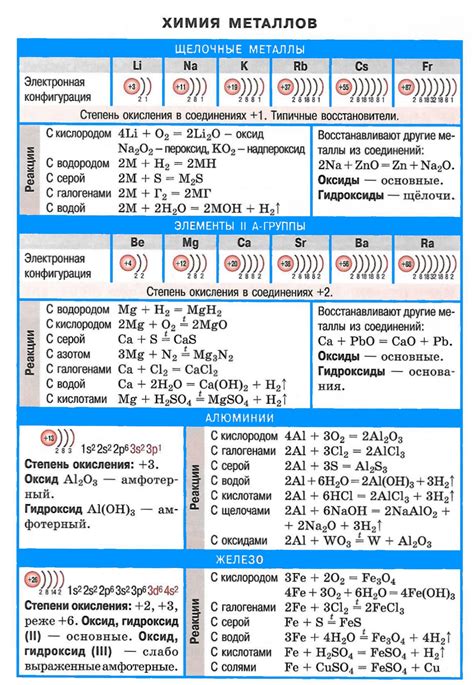
Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реактивностью и способны образовывать разнообразные химические соединения с различными веществами. В частности, их взаимодействие с солями является важным объектом изучения в химии.
Когда щелочные металлы вступают в реакцию с солями, образуется новое соединение – соль щелочного металла, которое обладает своими уникальными свойствами. Например, соли щелочных металлов широко используются в медицине, пищевой промышленности, а также в процессе производства стекла и щелочных аккумуляторов.
Взаимодействие щелочных металлов с солями происходит в соответствии с определенными химическими реакциями. Нередко такие реакции сопровождаются выделением газов или теплоты. Например, при растворении калия или натрия в воде, возникает высвобождение водорода, и образуется щелочное растворение соли.
Изучение химических свойств щелочных металлов с солями имеет важное практическое значение и удостоено большого внимания в научных исследованиях. Это позволяет расширить наши знания о химических процессах, происходящих при взаимодействии различных веществ, а также разработать новые способы их применения в различных областях науки и техники.
Физические и химические свойства щелочных металлов
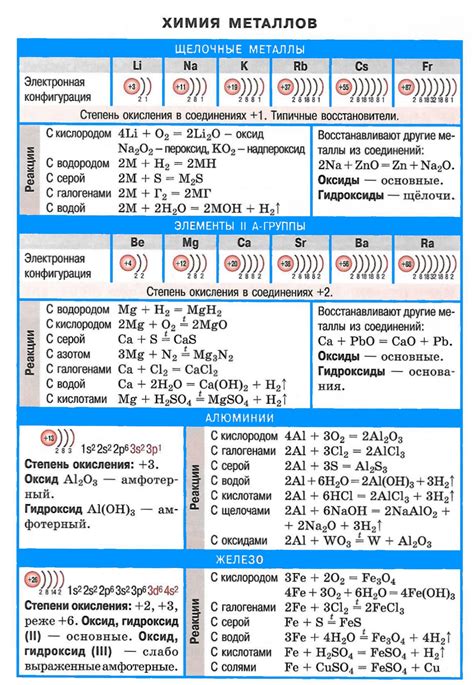
Основные физические свойства щелочных металлов
Щелочные металлы - это элементы первой группы периодической системы. Они обладают низкой плотностью и низкой температурой плавления, что делает их мягкими и легко расплавляемыми. Например, плотность лития составляет всего 0,53 г/см³.
Щелочные металлы обладают хорошей термической и электрической проводимостью, что делает их полезными в различных технологических процессах и в электротехнике.
Химические свойства щелочных металлов
Высокая химическая активность щелочных металлов обусловлена их низкой ионизационной энергией. Они легко образуют ионы с положительным зарядом, что делает их мощными окислителями и химически агрессивными веществами.
Щелочные металлы хорошо растворяются в воде, образуя щелочные растворы. Они обладают высокой щелочностью и могут нейтрализовать кислоты.
Щелочные металлы реагируют с множеством веществ, таких как кислород, халогены и некоторые неорганические соединения. Например, реакция лития с водой протекает с выделением водорода.
Щелочные металлы могут образовывать соли с различными анинами. Они являются основными компонентами многих солей, таких как хлориды, сульфаты и нитраты.
Влияние солей на химические свойства щелочных металлов
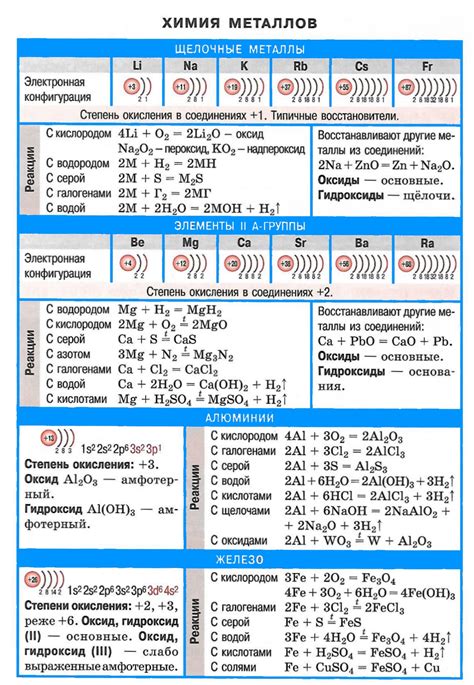
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой химической активностью и реакционной способностью. Они образуют соли, где они выступают в качестве катионов, обладающих положительным зарядом.
Влияние солей на химические свойства щелочных металлов проявляется в нескольких аспектах. Во-первых, соли щелочных металлов могут изменять структуру и свойства их кристаллической решетки. Примером такого влияния является образование гидратов или гидроксидов металлов, которые изменяют их растворимость и степень ионизации.
Во-вторых, соли щелочных металлов могут участвовать в реакциях активации их химических свойств. Они могут служить катализаторами или ингибиторами реакций, изменять скорость и направление химических превращений. Это позволяет использовать соли щелочных металлов в различных процессах, например, в синтезе органических соединений или в производстве биологически активных веществ.
Кроме того, соли щелочных металлов регулируют реакции окисления-восстановления и обладают высокой электрохимической активностью. Благодаря этому они находят широкое применение в батареях, аккумуляторах и других устройствах с электролитами.
В заключение, взаимодействие с солями оказывает значительное влияние на химические свойства щелочных металлов. Это явление изучается как в теоретическом, так и в практическом аспекте с целью разработки новых материалов и технологий.
Применение солей щелочных металлов в различных отраслях

Соли щелочных металлов имеют широкое применение в различных отраслях промышленности благодаря своим химическим свойствам. Они используются в производстве стекла, щелочных и керамических изделий, а также в текстильной, пищевой и металлургической промышленности.
Одним из наиболее известных применений солей щелочных металлов является их использование в производстве стекла. Натрий и калий, содержащиеся в солях, придают стеклу прозрачность и устойчивость к температурным воздействиям. Благодаря этому стекло может использоваться в различных сферах, включая строительство, автомобильную промышленность и производство бытовых предметов.
Соли щелочных металлов также находят применение в производстве щелочей и керамических изделий. Они являются необходимыми компонентами в процессе получения щелочных растворов, используемых в бытовой химии и промышленности. Кроме того, соли щелочных металлов активно применяются в керамической промышленности, включая производство кирпичей, плиток и посуды.
В текстильной промышленности соли щелочных металлов используются в процессе окрашивания и обработки ткани. Они помогают устойчивому закреплению красителей на волокнах, а также придают тканям дополнительные свойства, такие как антистатические и антибактериальные.
Соли щелочных металлов находят применение и в пищевой промышленности. Они используются в качестве пищевых добавок для консервации продуктов, регулирования кислотности и поддержания консистенции. Кроме того, соли щелочных металлов могут использоваться в качестве пищевых консервантов и антиоксидантов.
Наконец, соли щелочных металлов играют важную роль в металлургической промышленности. Они используются для получения алюминия, лития и других металлов, а также для легирования сталей и сплавов. Соли щелочных металлов улучшают свойства металлов, делая их более прочными и устойчивыми к коррозии.
Проблемы, связанные с использованием солей щелочных металлов
Использование солей щелочных металлов может вызывать некоторые проблемы и ограничения, связанные с их химическими свойствами и воздействием на окружающую среду.
Коррозия металлов: Соли щелочных металлов, особенно хлориды и сульфаты, проявляют агрессивное воздействие на металлические поверхности. В контакте с влажностью они способны вызывать коррозию и разрушение металлов, что может привести к повреждению инженерных систем и оборудования.
Загрязнение почвы и воды: Солями щелочных металлов активно пользуются в различных отраслях промышленности, в том числе в производстве удобрений и стекла, а также в нефтяной и газовой промышленности. Однако, несмотря на их широкое применение, неконтролируемое выбросы этих соединений в окружающую среду могут привести к серьезным последствиям. Они могут загрязнять почву и воду, что создает неблагоприятные условия для растительного и животного мира.
Токсичность: Некоторые соли щелочных металлов могут быть токсичными при попадании в организм человека или животных. Их воздействие может негативно сказываться на здоровье, вызывая различные патологические процессы. Поэтому необходимо обращать особое внимание на безопасное хранение и использование таких веществ.
Реактивность: Соли щелочных металлов имеют высокую реактивность и могут легко вступать в химические реакции, особенно при взаимодействии с другими веществами. Это может усложнять их хранение и транспортировку, а также возникают опасности связанные с возможностью неожиданного образования взрывоопасных смесей.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы обладают рядом химических свойств, которые делают их уникальными. Они очень реактивны и легко реагируют с водой, кислотами и другими веществами. Также, они образуют ионы с положительным зарядом, что делает их хорошими электролитами.
Что происходит при реакции щелочных металлов с водой?
При реакции щелочных металлов с водой образуется щелочь (гидроксид), газ водород и выделяется тепло. Например, натрий (Na) при реакции с водой образует гидроксид натрия (NaOH) и выделяет водород (H2).
Какие соли образуются при реакции щелочных металлов с кислотами?
При реакции щелочных металлов с кислотами образуются соли. Например, при реакции натрия (Na) с соляной кислотой (HCl) образуется соль - хлорид натрия (NaCl) и выделяется водород (H2).
Какие свойства имеют соли щелочных металлов?
Соли щелочных металлов обладают рядом химических свойств. Они растворяются хорошо в воде и образуют растворы, которые проводят электрический ток. Кроме того, соли этих металлов имеют характерный вкус.
Какие свойства имеют соли щелочных металлов в растворе?
Соли щелочных металлов в растворе образуют ионы, которые обладают электрическим зарядом. Это позволяет раствору проводить электрический ток. Кроме того, в растворе солей можно наблюдать некоторые типичные свойства, такие как изменение цвета или образование осадка при взаимодействии с другими веществами.
