Окисление щелочных металлов является одним из наиболее распространенных явлений в химии. Щелочные металлы - это элементы первой группы периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Эти металлы обладают высокой реакционной способностью и склонны к образованию окислов. Окисление щелочных металлов имеет большое значение в различных областях, включая промышленность и исследования.
Щелочные металлы имеют тенденцию к отдаче своего внешнего электрона, образуя ион положительного заряда (катион). Этот процесс называется окислением, так как металл теряет электрон. Окисление щелочных металлов может происходить в присутствии кислорода, воды или других окислителей. В результате образуется ионическое соединение, состоящее из катионов щелочных металлов и анионов оксидов или гидроксидов.
Высокая реакционная способность щелочных металлов объясняется их электрохимическими свойствами. Щелочные металлы имеют малую энергию ионизации, что означает, что энергия, необходимая для удаления электрона из атома, относительно низкая. Это делает их склонными к окислению и образованию положительных ионов. Кроме того, щелочные металлы имеют большую аффинность кислорода, что позволяет им легко соединяться с ним в процессе окисления.
Окисление щелочных металлов имеет широкий спектр применений. Например, окисление калия приводит к образованию калийного гидроксида (поташа), который широко используется в производстве мыла и удобрений. Окисление натрия приводит к образованию натриевого гидроксида (каустическая сода), который используется в промышленности, например, для очистки и обезжиривания поверхностей.
Окисление щелочных металлов
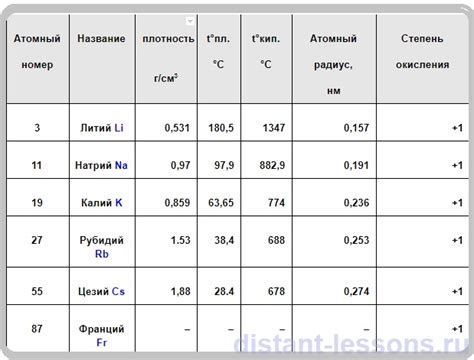
Щелочные металлы – это элементы, расположенные в первой группе периодической системы. К основным щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой реакционной способностью и легкостью окисления.
Окисление щелочных металлов происходит при контакте с кислородом воздуха. В результате реакции между щелочным металлом и кислородом образуется соответствующий оксид металла. Например, при окислении калия образуется калиевый оксид (K2O), а при окислении натрия – натриевый оксид (Na2O).
Окисление щелочных металлов также может происходить в реакции с водой. При контакте с водой щелочные металлы образуют гидроксиды. Например, калий реагирует с водой, образуя калиевую щелочь (KOH), а натрий – натриевую щелочь (NaOH).
Важно отметить, что окисление щелочных металлов протекает очень быстро и с выделением большого количества тепла. При контакте с водой может возникать взрывоопасная ситуация. Поэтому при работе с щелочными металлами необходимо соблюдать все меры предосторожности и работать в специально оборудованных помещениях.
Окисление щелочных металлов играет важную роль в различных химических процессах. Например, гидрооксиды щелочных металлов являются основной составляющей многих бытовых и промышленных продуктов, таких как мыло, стекло, удобрения и другие.
Основные химические свойства

Щелочные металлы – это элементы периодической таблицы, которые обладают высокими химическими реакционными способностями их внешних электронных оболочек.
1. Окисление. Щелочные металлы хорошо окисляются воздухом при комнатной температуре. Например, натрий и калий быстро покрываются оксидной пленкой воздушным кислородом. Это свойство связано с их большой активностью и низкой энергией ионизации.
2. Реакция с водой. Щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород. При этой реакции выделяется большое количество тепла, что приводит к самовозгоранию водорода. Ионы металлов взаимодействуют с молекулами воды, образуя гидроксидные ионы и освобождая энергию.
3. Реакция с кислородом. Щелочные металлы реагируют с кислородом, образуя оксиды. Реакции с кислородом происходят как при обычной, так и при повышенной температуре. Например, литий сгорает при контакте с кислородом, образуя оксид лития.
4. Спонтанное горение. Щелочные металлы, в частности калий и натрий, могут возгораться спонтанно при контакте с воздухом. Это свойство связано с высокой реакционной способностью их внешней электронной оболочки.
5. Образование оксидов и гидроксидов. Щелочные металлы образуют оксиды и гидроксиды, которые хорошо растворяются в воде и образуют щелочные растворы. Например, натрий образует гидроксид натрия, который является сильным основанием и широко используется в промышленности и в быту.
Влияние окружающей среды

Окисление щелочных металлов может происходить под влиянием различных факторов окружающей среды. В частности, воздействие кислорода, влаги и температуры может значительно ускорить процесс окисления.
Кислород является одним из основных окислителей, который обычно присутствует в атмосфере. Щелочные металлы реагируют с кислородом и образуют оксиды. Например, литий может образовывать оксид лития (Li₂O) или пероксид лития (Li₂O₂) в зависимости от условий окисления.
Влага также может играть важную роль в процессе окисления щелочных металлов. Водная пар и влажность воздуха могут способствовать образованию гидроксидов или пероксидов соответствующих металлов. Например, натрий может образовывать пероксид натрия (Na₂O₂) при взаимодействии с влагой воздуха.
Также температура окружающей среды может оказывать влияние на скорость окисления щелочных металлов. Высокая температура может способствовать интенсивному потреблению кислорода и ускоренному образованию оксидов или пероксидов металлов.
Физические и химические свойства оксидов щелочных металлов
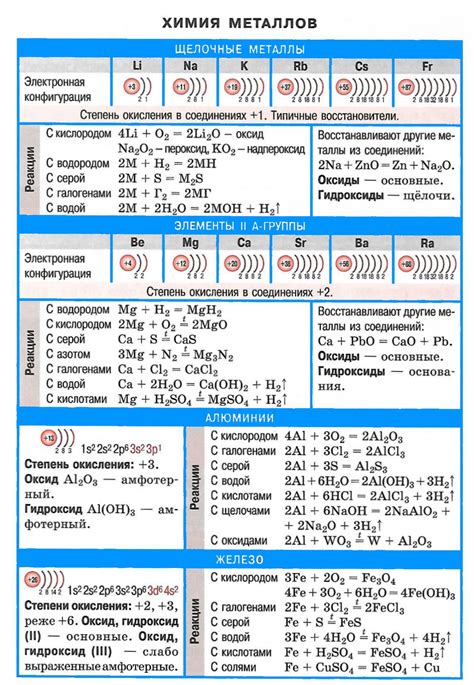
Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Оксиды этих металлов обладают рядом характеристических физических и химических свойств.
Физические свойства
- Оксиды щелочных металлов обычно представляют собой бесцветные или белые кристаллические вещества, характеризующиеся высокой термической и электрической проводимостью.
- Они обладают высокой температурной стабильностью и обычно не легко распадаются при нагревании.
- Оксиды щелочных металлов обычно имеют высокую плотность и твердость.
Химические свойства
- Оксиды щелочных металлов хорошо растворяются в воде, образуя гидроксиды, которые сильные основания.
- Они обладают амфотерными свойствами, способностью образовывать соли и осязаемо присутствовать в реакциях окисления-восстановления.
- Оксиды щелочных металлов могут быть взрывоопасными в сочетании с некоторыми веществами, например с жиром и горючими материалами.
- Они являются хорошими катализаторами в реакциях окисления и восстановления.
Оксиды щелочных металлов имеют широкий спектр применения в различных областях, таких как производство стекла, керамики, строительных материалов и фармацевтической продукции. Их химические и физические свойства делают их важными компонентами в различных процессах и реакциях.
Процессы окисления и их применение в научных и промышленных целях

Окисление щелочных металлов — процесс, в результате которого их атомы теряют один или несколько электронов. Это явление имеет большое значение как в научных исследованиях, так и в промышленном производстве.
В научных целях процессы окисления широко изучаются для понимания химических реакций и свойств веществ. Окисление щелочных металлов может быть использовано для определения концентрации веществ в растворах, а также для изучения электрохимических свойств различных материалов.
В промышленности окисление щелочных металлов применяется в различных процессах. Например, при получении алкоголей из алкенов используется катализатор на основе окисленного щелочного металла. Этот процесс является одним из основных методов промышленного производства спиртов и пластмасс. Кроме того, окисление щелочных металлов широко применяется в производстве батарей и аккумуляторов, где они служат источником электрической энергии.
Таким образом, процессы окисления щелочных металлов имеют большое значение как в научных исследованиях, так и в промышленном производстве. Изучение и применение этих процессов помогают нам лучше понять химические реакции и свойства веществ, а также разрабатывать новые технологии и материалы для различных областей промышленности.
Взаимодействие щелочных металлов с галогенами при окислительных реакциях

Щелочные металлы (литий, натрий, калий, рубидий, цезий) являются сильными окислителями, а галогены (фтор, хлор, бром, йод) - мощными восстановителями. Взаимодействие этих веществ при окислительных реакциях приводит к образованию химических соединений и выделению большого количества энергии.
При контакте щелочных металлов с галогенами происходит обмен электронами между веществами. Щелочные металлы отдают электроны, становясь положительно заряженными ионами, а галогены принимают электроны, становясь отрицательно заряженными ионами.
Такое взаимодействие приводит к образованию ионных соединений - солей галогеновых кислот. Например, при взаимодействии калия с хлором образуется хлорид калия (KCl), а при взаимодействии натрия с бромом образуется бромид натрия (NaBr).
Окисление щелочных металлов галогенами является экзотермической реакцией, то есть сопровождается выделением тепла и света. При сильном нагревании такая реакция может протекать с огнём и образованием ярко горящего пламени. Примером такой реакции является окисление калия фтором, при котором образуется хлорид калия и выделяется ярко-фиолетовое пламя.
Изменения электрохимических свойств щелочных металлов при окислении
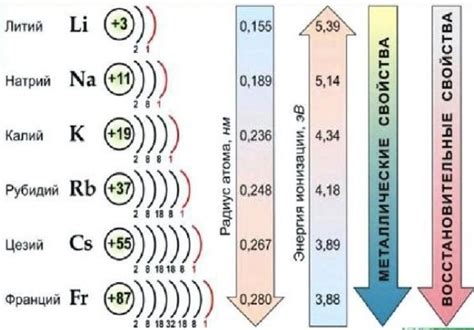
Окисление щелочных металлов, таких как литий, натрий, калий, может привести к значительным изменениям их электрохимических свойств. При окислении щелочные металлы образуют положительные ионы, что влияет на их реакционную активность и способность участвовать в электрохимических процессах.
Первым щелочным металлом в периоде является литий. При окислении литий образует ион Li+, который обладает высокой электрохимической активностью. Это делает его идеальным компонентом для использования в литий-ионных батареях, которые обладают высокой энергоемкостью и долгим сроком службы.
Натрий, являющийся вторым щелочным металлом в периоде, также образует положительные ионы Na+ при окислении. Эти ионы обладают большей реакционной активностью по сравнению с ионами лития, что делает их подходящими для использования в производстве сплавов и других химических реакциях.
Калий, третий щелочный металл в периоде, также обладает высокой электрохимической активностью при окислении. Калиевые ионы K+ являются стабильными и могут использоваться в электролитах для батарей, а также в других электрохимических процессах.
В целом, окисление щелочных металлов приводит к изменению их электрохимических свойств. Образование положительных ионов при окислении делает эти металлы более реакционно-способными и подходящими для широкого спектра применений в электрохимии, производстве сплавов и других химических процессах.
Вопрос-ответ

Что такое окисление щелочных металлов?
Окисление щелочных металлов - это процесс, при котором атомы щелочных металлов, таких как литий, натрий, калий, реагируют с кислородом из воздуха, образуя соответствующие оксиды.
Каковы основные химические свойства щелочных металлов при окислении?
При окислении щелочных металлов образуется соответствующий оксид, например, оксид лития (Li2O), оксид натрия (Na2O) или оксид калия (K2O). Эти оксиды обладают щелочными свойствами, то есть легко реагируют с водой, образуя гидроксиды щелочных металлов. Также оксиды щелочных металлов могут использоваться в производстве стекла и керамики.
