Щелочные металлы - это группа элементов периодической таблицы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают уникальными химическими свойствами, которые делают их важными в различных отраслях науки и индустрии.
Одной из особенностей щелочных металлов является их низкое значение энергии ионизации. Это означает, что эти элементы легко отдают свой внешний электрон, образуя положительные ионы (катионы). Эта способность делает щелочные металлы отличными ведущими, которые могут быть использованы в электропроводных приложениях.
Кроме того, щелочные металлы обладают сильными основными свойствами и могут растворяться в воде, образуя щелочные растворы. Это их способность реагировать с водой вызывает такие явления, как дегидрирование и выделение водорода. Щелочные металлы также реагируют с другими веществами, такими как кислород, сера и азот, создавая различные химические соединения.
Важно отметить, что щелочные металлы являются очень реактивными и должны быть предельно осторожны в обращении с ними. Они могут вызывать ожоги на коже и взрывоопасны в присутствии воздуха или влаги. Имея сильные основные свойства, они могут нейтрализовать кислоты и образовывать соли.
Использование щелочных металлов в различных областях науки и технологий включает батареи, проводники, катализаторы, лекарственные препараты и другие. Изучение их химических свойств помогает улучшить наши знания о взаимодействии веществ и разрабатывать новые технологии и материалы с помощью этих уникальных элементов.
Химические свойства щелочных металлов

Щелочные металлы представляют собой группу элементов, включающую литий, натрий, калий, рубидий, цезий и франций. Они имеют ряд уникальных химических свойств, которые обусловлены их положением в таблице химических элементов.
Первое отличительное свойство щелочных металлов - это их металлический блеск. Они мягкие и довольно низкоплавкие, что делает их пластичными и хорошо обрабатываемыми. Они также очень реактивны, особенно в контакте с водой и кислородом, что делает их взрывоопасными.
Одна из самых известных реакций щелочных металлов - это их реакция с водой. При этом образуется щелочное гидроксидное соединение и выделяется водород. Например, реакция натрия с водой протекает по следующему уравнению: 2Na + 2H2O = 2NaOH + H2. Эта реакция сопровождается ярким горением и выделением тепла.
Еще одним особенным свойством щелочных металлов является их способность вступать в реакцию с кислородом. При воздействии кислорода щелочные металлы образуют оксидные соединения. Например, натрий при воздействии кислорода образует оксид натрия (Na2O).
Щелочные металлы также являются отличными окислителями. Они легко отдают свои электроны и образуют ионы с положительным зарядом. Например, калий легко окисляется до формирования иона K+.
Также стоит отметить, что щелочные металлы обладают высокой электроотрицательностью, что делает их инертными и стабильными в реакциях с другими элементами. Однако, они могут образовывать соединения с другими металлами и неметаллами, что делает их полезными материалами в различных промышленных процессах.
Особенности химических свойств щелочных металлов
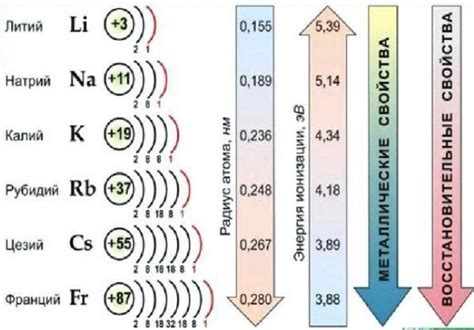
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они обладают уникальными химическими свойствами, которые отличают их от других элементов.
Во-первых, щелочные металлы хорошо растворяются в воде, образуя щелочные растворы. При этом происходит образование гидроксидов, например, гидроксид натрия (NaOH) или гидроксид калия (KOH). Эти гидроксиды отличаются высокой щелочностью и часто используются в промышленности и быту.
Во-вторых, щелочные металлы являются сильными редукторами. Они легко отдают свои электроны и образуют ионы с положительным зарядом. Например, ион натрия имеет заряд +1 (Na+), а ион калия - +1 (K+). Благодаря своему редукционному потенциалу, щелочные металлы взаимодействуют с множеством веществ, образуя различные соединения и реагенты.
В-третьих, щелочные металлы обладают низкой плотностью и низкой температурой плавления. Например, литий – самый легкий металл в периодической системе, а его плотность составляет всего 0,53 г/см³. Также щелочные металлы обладают низкой температурой плавления по сравнению с другими металлами, что делает их более пластичными и облегчает их использование в различных промышленных процессах.
Итак, химические свойства щелочных металлов определяют их широкое применение в науке, промышленности и повседневной жизни. Они являются важными компонентами многих соединений, катализаторов, реактивов и используются в различных технологиях, начиная от производства стекла и мыла, и заканчивая аккумуляторами и ядерными реакторами.
Реактивность щелочных металлов в воздухе и в воде

Щелочные металлы (литий, натрий, калий, рубидий и цезий) обладают высокой реактивностью и способностью активно взаимодействовать с различными веществами. Реакции щелочных металлов в воздухе и в воде являются основными способами проявления их химической активности.
В воздухе щелочные металлы быстро окисляются, образуя оксиды или пероксиды. Например, литий при контакте с кислородом образует Li2O или Li2O2. Калий взаимодействует с кислородом, образуя K2O или K2O2. Реакция взаимодействия металлов с кислородом происходит с выделением тепла.
В воде щелочные металлы реагируют очень активно, образуя гидроксиды и выделяя водород. Например, натрий прореагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водородный газ (H2). При этой реакции происходит значительное выделение тепла и образование щелочной среды.
Щелочные металлы также реагируют с некоторыми неметаллами, образуя соли. Например, натрий может вступать в реакцию с хлором, образуя хлорид натрия (NaCl).
Реактивность щелочных металлов обусловлена их электрохимическими свойствами и строением атомов. Благодаря низкой ионизационной энергии и высокому активному электрону в внешней оболочке, щелочные металлы легко отдают электрон и образуют ионы с положительным зарядом.
Взаимодействие щелочных металлов с кислотами

Щелочные металлы - это элементы первой группы периодической системы, которые обладают высокой химической активностью. Они проявляют реакцию с кислотами, об образовании солей и выделении водорода.
При взаимодействии щелочных металлов с кислотами происходит образование соответствующих солей, воды и выделение водорода. Например, взаимодействие натрия с соляной кислотой приводит к образованию хлорида натрия, воды и выделению водорода по следующему уравнению: 2Na + 2HCl = 2NaCl + H2.
Этот процесс обусловлен высокой активностью щелочных металлов и их способностью легко отдавать электроны. При контакте с кислотами, щелочные металлы отдают электроны, образуя ионы металла, которые реагируют с ионами водорода из кислоты, образуя соль и освобождая молекулы водорода.
Взаимодействие щелочных металлов с кислотами можно использовать в различных химических процессах и технологиях. Например, получение солей щелочных металлов может быть использовано в производстве удобрений или в пищевой промышленности для получения пищевых добавок.
Взаимодействие щелочных металлов с неметаллами

Щелочные металлы активно реагируют с неметаллами и образуют различные соединения. Взаимодействие этих элементов основывается на сильной электроотрицательности неметаллов и их способности к приему электронов.
Вода, величайший представитель неметаллов, реагирует с щелочными металлами, такими как натрий и калий, образуя гидроксиды соответствующих металлов. Например, реакция натрия с водой дает гидроксид натрия и выделяет водород. Это реактивное взаимодействие широко используется в лабораториях и промышленности для получения гидроксидов и водорода.
Кислород, составляющий большую часть земной атмосферы, также реагирует с щелочными металлами. Натрий, калий и другие металлы образуют оксиды, такие как оксид натрия и оксид калия, при взаимодействии с кислородом. Эти оксиды являются важными продуктами в химической промышленности и используются в процессах, связанных с очисткой газов и производством стекла.
Щелочные металлы также могут реагировать с другими неметаллами, такими как сера и галогены. Например, натрий реагирует с серой, образуя сульфид натрия. Калий может образовывать хлорид калия при реакции с хлором. Эти соединения широко используются в различных отраслях промышленности, включая производство удобрений и лекарственных препаратов.
Взаимодействие щелочных металлов с неметаллами имеет огромное значение во многих областях науки и промышленности. Понимание этих реакций позволяет разрабатывать новые материалы, процессы и технологии, которые могут быть полезными для человечества.
Вопрос-ответ

Какие основные свойства имеют щелочные металлы?
Щелочные металлы характеризуются высокой химической реактивностью, мягкостью и низкой плотностью. Они обладают способностью растворяться в воде и образовывать щелочные растворы. Также щелочные металлы обладают низкой электроотрицательностью и отдают электроны при химических реакциях.
Как ведут себя щелочные металлы при взаимодействии с кислородом?
При взаимодействии с кислородом щелочные металлы образуют оксиды и супероксиды. Например, натрий при контакте с кислородом образует оксид натрия (Na2O), а калий образует супероксид калия (KO2). Эти соединения являются основными, токсичными и обладают оксидирующими свойствами.
Чем обусловлена реактивность щелочных металлов?
Реактивность щелочных металлов обусловлена низкой электроотрицательностью и большим размером атомов. Это приводит к тому, что щелочные металлы легко отдают внешний электрон и образуют ионы с положительным зарядом. Большой размер атомов также способствует легкому разрушению их металлической решетки и реакции с другими веществами.
Каковы применения щелочных металлов в промышленности?
Щелочные металлы имеют широкое применение в промышленности. Например, натрий используется для производства щелочей, стекла, пластмасс и алюминия. Калий применяется в производстве удобрений, взрывчатых веществ и стекла. Литий используется в производстве аккумуляторов и лекарственных препаратов. Рубидий и цезий применяются в исследовательских целях и в производстве электроники.
Как изменяется реактивность щелочных металлов при возрастании атомного номера в периоде?
Реактивность щелочных металлов возрастает при возрастании атомного номера в периоде. Например, литий является наиболее реактивным металлом в своей группе, а цезий является наиболее реактивным металлом среди щелочных металлов в целом. Это связано с увеличением размера атома и слаблением электроотрицательности при переходе от лития к цезию.
