Литий и натрий - это два основных представителя щелочных металлов, которые находятся в первой группе периодической системы. Оба металла характеризуются рядом уникальных химических свойств, которые делают их одними из наиболее важных элементов в химии и технологии.
Литий - наименьший и легчайший из всех металлов. Он обладает высокой реакционной способностью, что проявляется в его активном взаимодействии с водой, кислородом и большинством неметаллов. Литий легко образует ионы Li+, которые обладают высокой подвижностью и способностью к экстремальному проявлению реакционности.
Натрий, в отличии от лития, имеет большую атомную массу и размеры, что делает его более реакционноспособным в сравнении с другими щелочными металлами. Он более активен в реакциях с водой, кислородом и другими химическими элементами. Натрий широко используется как реактив в различных химических процессах и промышленных производствах.
Оба этих металла имеют высокую электроотрицательность, что делает их сильными окислителями. Они обладают высокой теплопроводностью и электропроводностью, что обусловлено их металлической структурой и наличием свободных электронов в валентной оболочке.
Общие свойства щелочных металлов

Щелочные металлы представляют собой группу химических элементов, которые относятся к первой группе периодической системы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд общих химических свойств, которые делают их уникальными.
Первое общее свойство щелочных металлов - низкая плотность. Из-за своей малой плотности, эти элементы легкие и мягкие. Они могут быть резаны ножом или растерты в порошок. Например, литий обладает наименьшей плотностью среди щелочных металлов и является наименее плотным металлом в целом.
Второе общее свойство щелочных металлов - низкая температура плавления. Эти элементы имеют очень низкую температуру плавления, что означает, что они могут быть легко плавлены и применены в различных процессах. Например, натрий имеет температуру плавления всего лишь 97,8 градусов Цельсия.
Третье общее свойство щелочных металлов - высокая реактивность. Щелочные металлы реагируют с водой, кислородом и большинством неметаллов. Их реактивность объясняется их электрохимическим свойством, связанным с наличием одной электрона во внешней оболочке. Реакция щелочных металлов с водой, например, приводит к образованию щелочных гидроксидов и выделению водорода.
Четвертое общее свойство щелочных металлов - способность образовывать ионы с положительным зарядом. Эти элементы легко отдают электроны, образуя положительно заряженные катионы. Это свойство их делает химически активными и способными образовывать соли с различными отрицательными анионами.
В заключение, щелочные металлы обладают рядом общих свойств, таких как низкая плотность, низкая температура плавления, высокая реактивность и способность образовывать положительно заряженные ионы. Эти свойства делают эти элементы важными в различных областях, включая производство батарей, фертилизацию почвы и используются в фармацевтической промышленности.
Атомные и физические свойства щелочных металлов
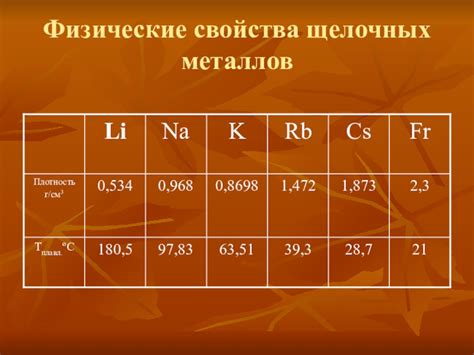
Щелочные металлы – это элементы первой группы периодической таблицы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются рядом особых атомных и физических свойств, которые делают их уникальными в химическом мире.
Первое отличительное свойство щелочных металлов – низкая плотность. Они являются наименее плотными из всех металлов. Например, плотность лития составляет всего 0,53 г/см3, а натрия – 0,97 г/см3. Их низкая плотность обусловлена большим объемом занимаемого атомами, что связано с их легковесностью.
Еще одной характерной особенностью щелочных металлов является низкая температура плавления. Например, литий плавится при температуре 180,5 °C, а натрий – при 97,8 °C. Это делает их достаточно мягкими и пластичными, что позволяет легко обрабатывать их при добыче и использовании.
Кроме того, щелочные металлы обладают низкой твердостью и хорошей электропроводностью. Их твердость не превышает 1,5 по шкале Мооса, что делает их легко режущими и деформируемыми. Они также хорошо проводят электрический ток, что делает их важными элементами в электронике и электротехнике.
Суммируя все вышесказанное, можно сделать вывод, что атомные и физические свойства щелочных металлов, таких как низкая плотность, низкая температура плавления, низкая твердость и хорошая электропроводность, делают эти элементы уникальными и полезными во многих областях науки и техники.
Химические свойства щелочных металлов

Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Химические свойства щелочных металлов в значительной степени определяются их электрохимической активностью и способностью образовывать ионы положительного заряда.
Литий - самый легкий металл из этой группы и обладает наименьшей электрохимической активностью. Он быстро реагирует с водой, образуя литиевую гидроксидную соль и высвобождая водород. Литий также реагирует с кислородом и азотом, образуя оксиды и нитриды. Кроме того, литий может образовывать соединения с неорганическими и органическими соединениями.
Натрий является более реакционноспособным, чем литий. Он реагирует с водой, образуя гидроксид натрия и высвобождая водород. Натрий также реагирует с азотом, образуя нитрид натрия. Он образует множество неорганических и органических соединений, часто используемых в промышленности и быту, таких как карбонат натрия и хлорид натрия. Натрий также используется в производстве стекла и щелок.
В целом, щелочные металлы имеют высокую реакционность и образуют стабильные ионы положительного заряда. Они хорошо растворяются в воде и образуют щелочные растворы. Они также являются хорошими проводниками электричества и тепла. Щелочные металлы широко используются в различных промышленных и технологических процессах, а также в производстве батарей и лекарственных препаратов.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий и натрий, широко применяются в различных сферах промышленности благодаря своим уникальным химическим свойствам.
Литий, например, находит применение в производстве легких аккумуляторов для портативных устройств, таких как мобильные телефоны и ноутбуки. Это связано с его способностью обеспечивать высокую энергоемкость, небольшой вес и длительное время работы. Кроме того, литий используется в производстве специальных стекол, керамики и лаков, которые обладают высокой прочностью и стойкостью к теплу.
Натрий, в свою очередь, широко применяется в производстве щелочных батарей, керамических материалов и стекла. Он также используется в сплавах с другими металлами для создания легких и прочных материалов, которые находят применение в авиационной и автомобильной промышленности. Благодаря своим свойствам, натрий также используется для очистки металлов от окислов и загрязнений.
Оба щелочных металла имеют широкое применение в химической промышленности. Литий используется в производстве листовых металлов, а также в синтезе органических соединений и фармацевтических препаратов. Натрий находит применение в производстве пищевых добавок, красителей и моющих средств.
В целом, щелочные металлы играют важную роль в различных отраслях промышленности благодаря своим химическим свойствам и возможностям применения в различных процессах производства.
Вопрос-ответ

Какие химические свойства имеют щелочные металлы?
Щелочные металлы, такие как литий и натрий, обладают рядом основных химических свойств. Они являются хорошими проводниками электричества и тепла, легко вступают в реакцию с водой, образуя щелочные растворы, и способны образовывать соли с кислотами. Они также обладают низкой электроотрицательностью и низкой плотностью.
Какие реакции происходят при взаимодействии лития и натрия с водой?
Когда литий или натрий реагируют с водой, образуется щелочное растворимое гидроксидное соединение и выделяется водород. Например, при реакции лития с водой образуется гидроксид лития (LiOH) и выделяется водородный газ (H2). Эти реакции являются сильно экзотермическими и могут сопровождаться выделением пламени и шипением.
