Щелочные металлы — это элементы, которые относятся к первой группе периодической системы химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название из-за своей реакционной способности с водой, которая раньше называлась щелочью.
Основные свойства щелочных металлов заключаются в их мягкости, низкой плотности, низкой температуре плавления, хорошей электропроводности и активности. Все они являются бесцветными металлами, имеющими гладкую поверхность и реагирующими со многими веществами, включая воду, кислород и серу. Щелочные металлы обладают высокой реакционной способностью, что делает их полезными в различных областях жизни человека.
Применение щелочных металлов разнообразно. Литий, например, используется в производстве литий-ионных аккумуляторов, которые широко распространены в электронике и транспортных средствах. Натрий находит применение в пищевой промышленности, а также в производстве стекла и мыла. Калий используется в сельском хозяйстве для удобрения почвы, а также как составляющая минеральных удобрений и моющих средств. Также щелочные металлы находят применение в производстве огнетушителей, ядерных реакторов и многих других отраслях промышленности.
Важно знать, что щелочные металлы являются химически активными, их необходимо хранить в специальных условиях и использовать с осторожностью, чтобы избежать несчастных случаев и аварий.
Щелочные металлы: определение и химические свойства

Щелочные металлы представляют собой группу химических элементов, которые находятся в первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом характерных свойств, которые делают их уникальными и широко применяемыми в различных отраслях науки и промышленности.
Химические свойства щелочных металлов включают высокую реактивность и активность, низкую плотность, низкую температуру плавления и кипения, а также способность образовывать сильные основания. Они реагируют с водой, кислородом, хлором и другими неметаллами, образуя различные химические соединения, в том числе оксиды, галогениды и гидриды. Кроме того, они обладают высокой электропроводностью и малой теплопроводностью.
Щелочные металлы выполняют важные роли в жизни и технологии. Например, натрий используется в производстве стекла, а калий - в сельском хозяйстве в качестве удобрения. Литий применяется в аккумуляторах и лекарственных препаратах, а рубидий и цезий - в научных исследованиях, лазерной технике и атомных часах. Франций, самый редкий и радиоактивный из щелочных металлов, имеет ограниченное применение в научных исследованиях.
- Щелочные металлы обладают высокой активностью и способностью образовывать стабильные и нестабильные соединения.
- Их химическая реактивность позволяет использовать их в синтезе органических соединений и в производстве промышленных продуктов.
- Взаимодействие щелочных металлов с водой приводит к выделению водорода и образованию щелочных гидроксидов.
| Элемент | Атомный номер | Относительная атомная масса |
|---|---|---|
| Литий | 3 | 6.941 |
| Натрий | 11 | 22.990 |
| Калий | 19 | 39.098 |
| Рубидий | 37 | 85.468 |
| Цезий | 55 | 132.905 |
| Франций | 87 | 223.000 |
Физические свойства щелочных металлов: плотность и температура плавления
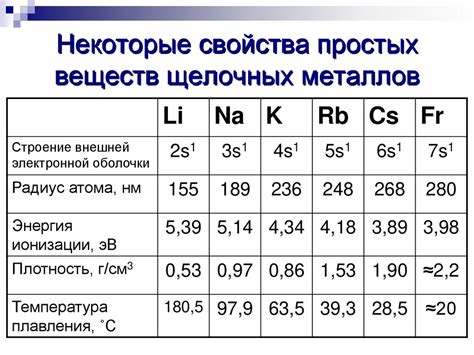
Щелочные металлы - это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Одной из характеристик, которая отличает щелочные металлы, является их низкая плотность. Плотность этих элементов попадает в диапазон от 0,53 г/см³ (у лития) до 1,87 г/см³ (у цезия).
Одной из причин низкой плотности щелочных металлов является их относительно большой атомный радиус. Отсутствие внутренних электронов в валентной оболочке дает возможность атомам раздвигаться и занимать более объемное пространство. Это приводит к увеличению межатомных расстояний и, как результат, к снижению плотности.
Однако, несмотря на низкую плотность, щелочные металлы характеризуются высокими температурами плавления. Температура плавления лития составляет около 180 градусов Цельсия, а цезия - около 28 градусов Цельсия. Это объясняется тем, что щелочные металлы имеют слабую валентную связь, которая требует большого количества энергии для разорвания при нагревании.
Высокая температура плавления щелочных металлов делает их востребованными в различных областях применения. Например, натрий и калий используются в производстве стекла и керамики, благодаря своим особым свойствам при плавлении. Также щелочные металлы находят применение в батареях и аккумуляторах, а также в производстве сплавов и катализаторов.
Реакция щелочных металлов с водой и кислородом: образование гидроксидов и оксидов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают высокой химической активностью и легко реагируют с водой и кислородом.
Реакция щелочных металлов с водой приводит к образованию гидроксидов. При этом, металл активно вступает в реакцию с молекулами воды, освобождая водород и образуя гидроксид металла. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O → 2NaOH + H2
Реакция щелочных металлов с кислородом приводит к образованию оксидов. В этом случае металл вступает в реакцию с кислородом, образуя оксид металла. Например, реакция калия с кислородом выглядит следующим образом:
4K + O2 → 2K2O
Образование гидроксидов и оксидов щелочных металлов является одним из основных химических свойств этих элементов. Гидроксиды щелочных металлов широко применяются в различных отраслях промышленности, в том числе в производстве стекла, мыла, моющих средств и др. Оксиды щелочных металлов также имеют применение, например, оксид калия используется в качестве катализатора в химических процессах.
Применение щелочных металлов в промышленности: производство сплавов и солей

Щелочные металлы – это группа химических элементов, включающая в себя литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом уникальных физических и химических свойств, что делает их важными для промышленных процессов.
Одним из основных применений щелочных металлов в промышленности является их использование в производстве сплавов. Например, литий используется для производства алюминиевых сплавов, которые обладают высокой прочностью и легкостью. Натрий и калий используются для создания различных сплавов с другими металлами, такими как свинец и цинк, для получения специальных свойств, таких как сопротивление коррозии и теплоустойчивость.
Кроме того, щелочные металлы широко используются в производстве различных солей. Натрий и калий, например, используются для производства нитратов, которые широко применяются в сельском хозяйстве в качестве удобрений. Кроме того, нитраты натрия и калия используются в производстве различных красителей, пищевых добавок, а также в производстве стекла и мыла.
Рубидий и цезий также находят применение в производстве солей. Например, рубидий-перманганат используется в медицине в качестве антисептического средства, а цезий-юдрат используется в производстве фармацевтических препаратов и изотопов для медицинских исследований. Кроме того, щелочные металлы используются при производстве различных электронных компонентов, таких как аккумуляторы и солнечные батареи, благодаря своим уникальным электрохимическим свойствам.
Использование щелочных металлов в научных исследованиях и технологиях

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают уникальными свойствами, которые делают их идеальными для использования в научных исследованиях и различных технологиях.
Один из основных способов применения щелочных металлов - это в качестве компонента батарей. Литий-ионные аккумуляторы, содержащие литий, являются одними из самых популярных видов аккумуляторов в настоящее время. Они широко используются в портативных электронных устройствах, таких как смартфоны, планшеты и ноутбуки, а также в электрических автомобилях.
Другое важное применение щелочных металлов - это в производстве стекла. Натрий является ключевым компонентом стекла и используется для придания ему прозрачности и устойчивости. Благодаря наличию натрия, стекло становится более прочным и устойчивым к различным воздействиям.
Калий также находит применение в многих технологиях, особенно в сельском хозяйстве. Калийные удобрения широко используются для повышения плодородия почвы и улучшения урожайности. Калий способствует укреплению растений, повышает их иммунитет к болезням и помогает достичь более высоких урожаев.
Щелочные металлы также активно применяются в научных исследованиях. Их высокая химическая реактивность и электрохимические свойства делают их идеальными для создания новых соединений и материалов. Например, рубидий используется в различных исследованиях, связанных с оптикой и лазерной технологией.
Таким образом, щелочные металлы играют важную роль в научных исследованиях и технологиях. Их уникальные свойства широко используются в производстве батарей, стекла, удобрений и в научных исследованиях, способствуя развитию новых технологий и прогрессу в различных областях науки и промышленности.
Особенности хранения и обращения с щелочными металлами: меры предосторожности и экологические аспекты
Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой химической реактивностью и могут быть опасными при неправильном обращении. Поэтому при хранении и использовании этих металлов необходимо соблюдать определенные меры предосторожности.
Во-первых, щелочные металлы должны храниться в специальных контейнерах, которые предотвращают контакт с воздухом и влагой. Это необходимо из-за их высокой реактивности с кислородом и водой. Контейнеры должны быть плотно закрытыми и храниться в прохладном и сухом месте, чтобы предотвратить возможность самовозгорания или взрыва.
Во-вторых, при обращении с щелочными металлами необходимо надевать защитные перчатки, очки и фартук из несгораемого материала. Это позволит предотвратить возможные ожоги кожи и глаз при случайном контакте с металлами. Кроме того, следует избегать вдыхания паров или пыли, образующихся при реакции с влагой или кислородом.
Особое внимание следует уделять также экологическим аспектам при обращении с щелочными металлами. Их неправильное выбрасывание в окружающую среду может вызвать загрязнение воды, почвы и воздуха, а также негативно сказаться на живых организмах. Поэтому использованные контейнеры и остатки металлов следует сдавать в специальные пункты приема опасных отходов.
В целом, правильное хранение и обращение с щелочными металлами требуют соблюдения мер предосторожности для обеспечения безопасности и защиты окружающей среды. Эти металлы, несмотря на свою высокую реактивность, имеют широкое применение в различных отраслях, и поэтому важно проводить их обработку и утилизацию в соответствии с экологическими требованиями.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы обладают следующими основными свойствами: низкой плотностью, низкой температурой плавления, высокой реактивностью с водой и кислородом, мягкостью и низкой твердостью.
Какие именно металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
В чем заключается применение щелочных металлов?
Щелочные металлы имеют широкое применение. Например, литий используется в аккумуляторах и лекарствах, натрий в производстве стекла и мыла, калий в удобрениях и реактивной промышленности, рубидий и цезий в научных исследованиях.
Почему щелочные металлы реактивны с водой?
Щелочные металлы реактивны с водой из-за своей высокой активности и низкой ионизационной энергии. Они вытесняют водород из воды, образуя щелочные гидроксиды и выделяя горючий водород.
Какие опасности связаны с использованием щелочных металлов?
Щелочные металлы могут быть опасными из-за своей реактивности и высокой токсичности. Они могут приводить к ожогам при контакте с кожей и глазами, а также быть пожароопасными при взаимодействии с веществами, такими как вода или кислород.
