Щелочные металлы представляют собой группу элементов периодической системы, которые характеризуются высокой степенью активности и реакционной способностью. В этой статье мы рассмотрим основные химические свойства щелочных металлов и их применение в повседневной жизни.
Одной из характерных особенностей щелочных металлов является их способность быстро реагировать с водой. При контакте щелочного металла с водой происходит активное выделение водорода и образование щелочной соли. Эта реакция сопровождается выделением большого количества тепла, поэтому щелочные металлы используются для получения энергии в батареях и аккумуляторах.
Химические свойства щелочных металлов определяются их низкой ионизационной энергией и способностью отдавать свой внешний электрон. В результате этого они формируются положительно заряженными ионами и образуют ионные связи с отрицательно заряженными ионами других элементов. Эти свойства щелочных металлов позволяют им образовывать соли с различными кислотами и обладать высокой растворимостью в воде.
Кроме того, щелочные металлы обладают сильными щелочными свойствами, благодаря которым они растворяются в воде, образуя гидроксиды. Такие гидроксиды имеют щелочную реакцию и широко применяются в быту и промышленности. Например, гидроксид натрия (каустическая сода) используется в бытовой химии и производстве стекла, а гидроксид калия применяется в сельском хозяйстве для удобрения почвы.
Химические свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них есть общие химические свойства, которые определяются наличием одного электрона во внешней оболочке. Этот электрон легко отдаётся другим атомам, что делает щелочные металлы хорошими веществами-донорами.
Щелочные металлы реагируют с водой, образуя щелочи и выделяя водород. Процесс реакции усиливается при повышении активности металла в группе, например, реакция с калием более интенсивная, чем с литием. Реакция щелочных металлов с водой осуществляется по следующему уравнению:
2M + 2H2O → 2MOH + H2 (где M - щелочный металл)
Щелочные металлы также реагируют с кислородом, образуя оксиды металла. Например, реакция калия с кислородом представлена следующим уравнением:
4K + O2 → 2K2O
Щелочные металлы являются хорошими окислителями, они способны вступать в реакции с различными соединениями, переходя в более низкие степени окисления.
В заключение, химические свойства щелочных металлов определяются их высокой реакционной способностью и стремлением отдать внешний электрон, что делает их важными элементами в химии и промышленности.
Общая информация

Щелочные металлы – это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они находятся в первой группе периодической системы элементов и являются самыми активными металлами. Все щелочные металлы имеют один электрон во внешней электронной оболочке, что делает их очень реактивными.
Щелочные металлы обладают множеством характерных свойств. Они имеют низкую плотность и низкую температуру плавления. Они также очень мягкие и тугоплавкие. Кроме того, щелочные металлы являются отличными проводниками тепла и электричества.
Другим важным свойством щелочных металлов является их способность реагировать с водой. При контакте с водой, щелочные металлы образуют гидроксиды и выделяются водород. Реакция особенно яркая и взрывоопасная в случае с растворимыми щелочными металлами, такими как натрий и калий.
Щелочные металлы также обладают высокой реакционной способностью с кислородом и оксидами, что делает их мощными окислителями в химических реакциях. Они активно взаимодействуют с большинством неметаллов, образуя соли.
Реакция щелочных металлов с водой

Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий и цезий. Одной из наиболее известных химических реакций щелочных металлов является их реакция с водой.
Первый из щелочных металлов - литий - обладает наименьшей реактивностью по сравнению с другими элементами этой группы. При контакте с водой литий незначительно реагирует, образуя гидроксид лития (LiOH) и выделяяся водород (H2). Натрий, калий и другие щелочные металлы реагируют гораздо активнее.
Реакция щелочных металлов с водой протекает с образованием соответствующих гидроксидов и выделением водорода. Например, реакция натрия с водой образует гидроксид натрия (NaOH) и выделяется водород газ, который может воспламеняться. Реакции с калием, рубидием и цезием проходят аналогичным образом, но при более интенсивном выделении водорода.
Реакция щелочных металлов с водой имеет не только академическое значение, но и практическое применение. Гидроксиды щелочных металлов широко используются в производстве бытовой химии, косметических и фармацевтических препаратов, а также в других отраслях промышленности.
Образование гидроксидов
Гидроксиды являются щелочными соединениями, образующимися при взаимодействии щелочных металлов с водой. В результате этой реакции образуется гидроксид металла и выделяется водород. При этом происходит эндотермический процесс, то есть поглощение тепла.
Образование гидроксидов щелочных металлов происходит в несколько этапов. Сначала происходит ионизация металла: молекула металла отказывается от своего электрона и образует ион металла положительной заряды. Затем происходит присоединение иона металла к молекуле воды, в результате чего образуется гидроксид металла. Водород выделяется в виде газа.
Образование гидроксидов щелочных металлов является экзотермическим процессом, что значит, что при этой реакции выделяется тепло. Это связано с тем, что образование гидроксидов сопровождается освобождением большого количества энергии. Кроме того, гидроксиды щелочных металлов обладают слабыми основными свойствами и широко используются в различных областях, включая производство мыла, стекла и щелочей.
Реакция щелочных металлов с кислородом
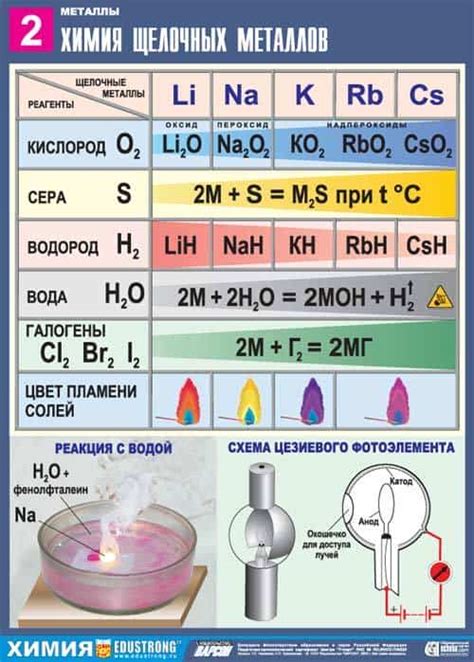
Кислород считается одним из самых активных элементов, способных образовывать соединения с другими элементами. В том числе, кислород может вступать в реакцию с щелочными металлами.
Для щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, реакция с кислородом протекает с образованием соединений, называемых оксидами. Оксиды щелочных металлов имеют общую формулу MO, где M обозначает металл.
В результате реакции щелочных металлов с кислородом образуются твердые вещества, которые имеют свойства оксидов. Например, оксид лития - белый кристаллический порошок, оксид натрия - белая кристаллическая соль, оксид калия - белый кристаллический порошок и т.д.
Реакция щелочных металлов с кислородом является экзотермической, то есть при ее протекании выделяется большое количество энергии в виде тепла и света. Поэтому, такая реакция может протекать с горением и образованием пламени.
Оксиды щелочных металлов обладают различными свойствами, которые определяют их применение в различных областях. Например, оксид натрия (едкая сода, или натр) используется в пищевой промышленности, оксид калия (поташ) - в производстве стекла, а оксид лития - в производстве аккумуляторов.
Взаимодействие щелочных металлов со вторичными металлами
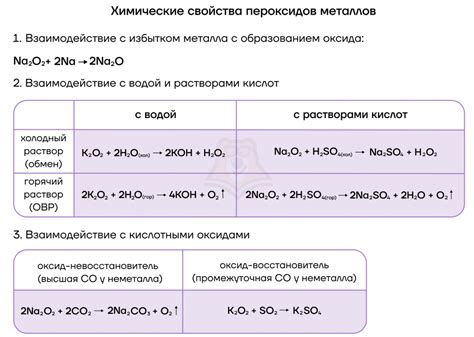
Щелочные металлы характеризуются высокой реакционной способностью и способностью образовывать соли. Взаимодействие щелочных металлов с вторичными металлами приводит к образованию сплавов, которые обладают различными физическими и химическими свойствами. Эти свойства сплавов зависят от процессов, происходящих при их образовании.
Взаимодействие щелочных металлов с вторичными металлами может происходить различными способами, включая растворение, образование сплавов и реакцию восстановления. Растворение щелочных металлов в составе сплавов может приводить к значительному понижению температуры плавления и улучшению механических свойств вторичных металлов. Образование сплавов щелочных металлов с вторичными металлами позволяет получить материалы с низкой плотностью и высокой прочностью.
Реакция восстановления, при которой щелочные металлы обладают высокой активностью, может приводить к образованию оксидов вторичных металлов. Восстановление оксидов может происходить под воздействием щелочных металлов в атмосфере или при нагревании в присутствии щелочных металлов. Это процесс могут использоваться для получения чистых металлов из оксидов.
Вопрос-ответ

Какие химические свойства характерны для щелочных металлов?
Щелочные металлы обладают рядом химических свойств, которые их отличают от других элементов таблицы. Одно из таких свойств - высокая реакционная способность. Они очень активно реагируют с водой, кислородом и другими веществами. Также к ним относится свойство образовывать ионы щелочных металлов, которые обладают однозначным положительным зарядом.
Что представляет собой реакция щелочных металлов с водой?
Реакция щелочных металлов с водой является достаточно ярким проявлением их реакционной способности. При контакте с водой они образуют щелочные гидроксиды и выделяются водород. Например, реакция натрия с водой выглядит следующим образом: 2Na + 2H2O → 2NaOH + H2↑. При этом реакция сопровождается выделением тепла.
Какие вещества реагируют с щелочными металлами?
Щелочные металлы реагируют с основами, кислотами, кислородом и некоторыми неметаллами. Например, они реагируют с кислородом, образуя оксиды щелочных металлов. Реакция между натрием и кислородом выглядит так: 4Na + O2 → 2Na2O. Также щелочные металлы реагируют с кислотами, образуя соответствующие соли. Например, реакция натрия с соляной кислотой выглядит так: 2Na + 2HCl → 2NaCl + H2↑.
Какова роль щелочных металлов в живых организмах?
Щелочные металлы играют важную роль в живых организмах. Например, калий и натрий являются необходимыми микроэлементами для нормального функционирования клеток человека и животных. Они участвуют в регуляции обмена веществ, передаче нервных импульсов и сократительной функции мышц. Кроме того, щелочные металлы присутствуют в составе некоторых ферментов и гормонов, которые необходимы для выполнения различных функций в организме.
