Щелочноземельные металлы – это элементы второй группы периодической системы, которые включают бериллий, магний, кальций, стронций, барий и радий. Они обладают рядом характерных химических свойств, которые определяют их поведение в реакциях и их роль в природе.
Во-первых, щелочноземельные металлы обладают высокой активностью, что означает, что они легко вступают в химические реакции. Например, они реагируют с водой, кислородом и большинством неметаллических элементов. Бериллий является исключением из этого правила, так как он обладает низкой активностью и не реагирует с водой или кислородом, образуя пассивную оксидную пленку на своей поверхности.
Во-вторых, щелочноземельные металлы образуют оксиды, гидроксиды и соли. Оксиды щелочноземельных металлов обладают основными свойствами и образуют гидроксиды, которые легко растворяются в воде, образуя щелочные растворы. Эти растворы имеют щелочную реакцию и широко используются в различных процессах.
В-третьих, щелочноземельные металлы образуют реакционные способности с кислотами. При этом они вытесняют из раствора другие металлы, так как обладают более высокой активностью. Например, магний может вытеснить медь из раствора ее соли, образуя свою соль и осаждая медь на поверхности.
Итак, химические свойства щелочноземельных металлов определяют их активность, их реакционную способность с кислотами и образование оксидов, гидроксидов и солей. Важно понимать эти свойства, чтобы понять и объяснить химические процессы, в которых участвуют щелочноземельные металлы.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа металлов, которые относятся к 2-й группе периодической системы элементов. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Химические свойства щелочноземельных металлов во многом определяют их положение в периодической системе. Основная характеристика данных элементов - электронная конфигурация, которая имеет общую особенность. Внешний электронный слой у щелочноземельных металлов содержит два электрона, что делает их химически активными.
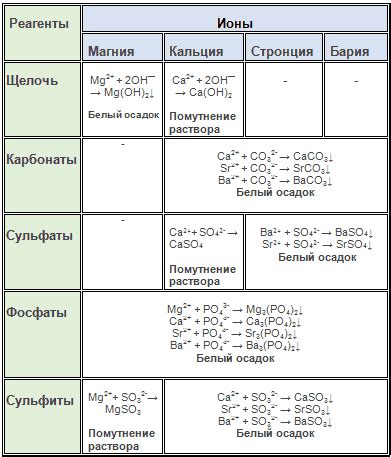
Одной из особенностей химических свойств щелочноземельных металлов является их способность образовывать ионы с положительным зарядом. При взаимодействии с водой, они образуют гидроксиды, которые являются щелочами. Также они способны образовывать соединения с кислородом, серой, фосфором и другими неметаллами.
Другим важным химическим свойством щелочноземельных металлов является их реактивность. Они воспламеняются нагреванием в воздухе или плавлении, а также активно реагируют с водой, кислородом и другими химическими веществами. Кроме того, щелочноземельные металлы обладают хорошей термической и электрической проводимостью.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы - это элементы второй группы периодической системы, включающие бериллий, магний, кальций, стронций, барий и радий. Они обладают рядом характерных физических свойств, которые делают их уникальными и широко применяемыми в различных областях жизни.
Плотность и твердость. Щелочноземельные металлы характеризуются высокой плотностью и твердостью, что делает их прочными и устойчивыми к механическим воздействиям. Например, бериллий является одним из самых твердых металлов, применяемых в производстве сплавов и защитных покрытий.
Плавление и кипение. Щелочноземельные металлы имеют относительно низкие температуры плавления и кипения. Например, бериллий плавится при температуре около 1287°C, а магний - при 650°C. Это свойство делает их легко поддающимися обработке и литью.
Электропроводность. Щелочноземельные металлы являются хорошими проводниками электричества. Их металлическая структура и наличие свободных электронов обеспечивают высокую электропроводность. Магний, например, широко используется в производстве проводов и кабелей.
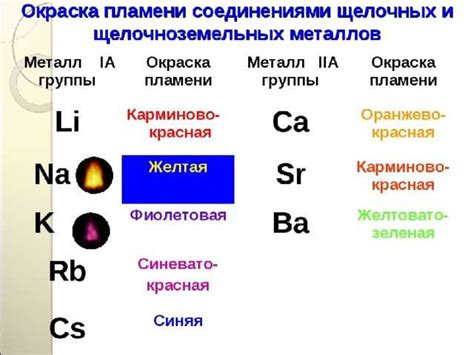
Яркость и отражательная способность. Щелочноземельные металлы обладают хорошей отражательной способностью и яркими металлическими блеском. Это делает их привлекательными для использования в ювелирном и декоративном искусстве. Например, барий и стронций часто используются для создания огней и световых эффектов в фейерверках.
Растворимость и реактивность. Щелочноземельные металлы растворяются в воде и образуют гидроксиды. Они также обладают способностью реагировать с кислородом, образуя оксиды. Например, реакция кальция с водой приводит к образованию гидроксида кальция и выделению водорода.
В заключение, физические свойства щелочноземельных металлов делают их полезными и важными в различных сферах жизни, начиная от промышленности и строительства, и заканчивая электроникой и медициной.
Реакции щелочноземельных металлов с кислотами

Щелочноземельные металлы, такие как магний, кальций и барий, обладают высокой активностью и реагируют с кислотами. Реакции щелочноземельных металлов с кислотами сопровождаются образованием соли и выделением водорода.
Например, реакция магния с соляной кислотой выглядит следующим образом:
- Mg + 2HCl = MgCl2 + H2
В результате реакции образуется хлорид магния и выделяется молекуларный водород. Реакция кальция с серной кислотой имеет аналогичное уравнение:
- Ca + H2SO4 = CaSO4 + H2
В этом случае образуется сульфат кальция и выделяется водород. Реакция бария с азотной кислотой показывает схожую картину:
- Ba + 2HNO3 = Ba(NO3)2 + H2
Образуется нитрат бария и молекулярный водород. Реакции щелочноземельных металлов с кислотами происходят с различной интенсивностью, что связано с активностью металлов и их способностью образовывать ионы в растворе.
Способы получения щелочноземельных металлов
Щелочноземельные металлы - это элементы второй группы периодической системы, включающие бериллий, магний, кальций, стронций, барий и радий. Каждый из этих металлов можно получить различными способами.
1. Извлечение из минералов: Щелочноземельные металлы часто встречаются в виде соединений в природе. Например, бериллий можно получить из минерала райнолит, а магний - из минерала доломит. Для получения металлов из минералов применяют различные технологии, такие как обжигание, флотация и растворение.
2. Электролиз: Еще один способ получения щелочноземельных металлов - это электролиз. При электролизе соединений щелочноземельных металлов происходит разложение вещества на ионы металла и ионы других элементов. Затем ионы металла осаждается на катоде, а другие ионы покидают систему. Этот метод широко применяется для получения магния и алюминия из соответствующих соединений.
3. Металлотермические реакции: Металлотермические реакции - это реакции, в результате которых происходит взаимодействие металла с другим веществом при повышенной температуре. Например, барий и радий можно получить путем металлотермической реакции с хлоридом бария или хлоридом радия соответственно. В данном методе металл реагирует с веществом, и образовавшийся продукт отделяется от металла.
Итак, существует несколько способов получения щелочноземельных металлов: извлечение из минералов, электролиз и металлотермические реакции. Каждый из этих методов имеет свои преимущества и недостатки, и выбор способа зависит от конкретных условий и требований процесса получения металла.
Использование щелочноземельных металлов в промышленности

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций и барий, имеют широкое применение в различных отраслях промышленности.
Бериллий: этот металл обладает высокой прочностью и легкостью, поэтому он часто используется в производстве легких и прочных сплавов, а также в радиационной и атомной промышленности.
Магний: благодаря своей легкости и высокой прочности, магний используется в производстве автомобилей, авиационной и космической техники, а также в электронной промышленности.
Кальций: этот металл широко применяется в производстве арматурных сталей, сплавов и алюминиевого литья, а также в производстве строительных материалов и железнодорожной отрасли.
Стронций: благодаря своим светоотражательным свойствам, стронций используется в производстве красителей для стекла и керамики, а также в производстве сигнальных светофоров и ядерных реакторов.
Барий: этот металл используется в производстве светофильтров, рентгеновских лучей и ядерных реакторов, а также в производстве пигментов и смазок.
Таким образом, щелочноземельные металлы играют важную роль в промышленности и находят широкое применение в различных отраслях, благодаря своим уникальным химическим и физическим свойствам.
Сравнение щелочноземельных металлов с другими группами элементов
Щелочноземельные металлы, такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), обладают рядом характерных химических свойств, которые отличают их от других групп элементов в периодической системе химических элементов.
Во-первых, щелочноземельные металлы имеют два электрона в своей внешней электронной оболочке, что делает их химически активными и способными образовывать соли и соединения с другими элементами. Это отличает их от щелочных металлов (например, натрия и калия), которые имеют один электрон в внешней оболочке.
Во-вторых, щелочноземельные металлы имеют низкую электроотрицательность, что делает их хорошими восстановителями. Они легко отдают свои электроны и образуют ионы положительного заряда. Это отличает их от галогенов (например, фтора и хлора), которые имеют высокую электроотрицательность и образуют ионы отрицательного заряда.
Кроме того, щелочноземельные металлы имеют низкую плотность и низкую температуру плавления. Они также обладают высокой теплопроводностью и хорошей электропроводностью. Эти физические свойства делают щелочноземельные металлы полезными для различных технических и промышленных применений, таких как производство легких конструкционных материалов и проводников электричества.
Однако щелочноземельные металлы также имеют свои особенности и различия в химическом поведении. Например, магний является более реактивным и легко окисляется на воздухе по сравнению с кальцием, стронцием и барием. Барий, в свою очередь, является наиболее реактивным среди щелочноземельных металлов и может образовывать взрывоопасные соединения.
В целом, химические свойства щелочноземельных металлов делают их важными элементами для различных промышленных и технологических процессов. Их способность образовывать соли и соединения, их физические свойства и особенности в химическом поведении делают щелочноземельные металлы уникальными в периодической системе элементов.
Вопрос-ответ

Какие ионы образуются при реакции щелочноземельных металлов с водой?
Щелочноземельные металлы образуют положительно заряженные ионы - катионы. Например, магний образует ион Mg2+, кальций - ион Ca2+, стронций - ион Sr2+.
Какие свойства имеют щелочноземельные металлы?
Щелочноземельные металлы обладают рядом химических свойств. Например, они реагируют с водой, образуя гидроксиды и выделяя водород. Также они образуют разнообразные соединения с кислотами, оксидами и другими веществами.
Какие вещества можно использовать для получения щелочноземельных металлов?
Щелочноземельные металлы получают из своих соединений путем различных химических реакций. Например, для получения кальция можно использовать восстановление оксида кальция углеродом, а для получения магния - электролиз хлорида магния.
