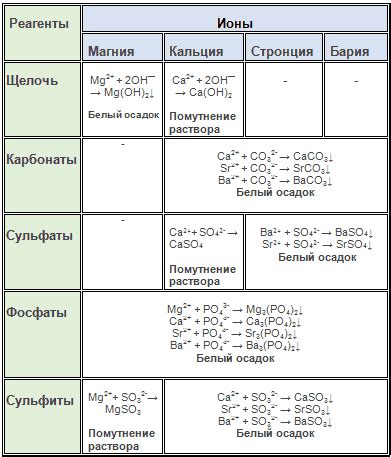
Щелочноземельные металлы - это группа химических элементов, включающая бериллий, магний, кальций, стронций, барий и радий. Они находятся во второй группе периодической системы элементов и обладают рядом общих свойств.
Свойства щелочноземельных металлов определяются их атомной структурой и электронной конфигурацией. Они обладают малой электроотрицательностью, что делает их хорошими металлическими проводниками тепла и электричества. В основном, они имеют два электрона в внешней энергетической оболочке, что делает их склонными к образованию ионов с двойным положительным зарядом.
Серa - это важный химический элемент, который широко используется в различных отраслях промышленности и науке. Реакции щелочноземельных металлов с серой могут происходить в разных условиях и приводить к образованию различных соединений.
Например, щелочноземельные металлы могут реагировать с серой при нагревании, что приводит к образованию сульфидов. Эти соединения обладают различными свойствами и могут использоваться в различных отраслях промышленности, таких как производство стекла, керамики и строительных материалов.
Также, реакции щелочноземельных металлов с серой могут происходить в водных растворах и приводят к образованию сульфатов. Сульфаты щелочноземельных металлов используются в производстве удобрений и в обработке питьевой воды.
Свойства щелочноземельных металлов

Щелочноземельные металлы – это группа химических элементов, состоящая из шести элементов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Они обладают рядом характерных свойств, которые делают их уникальными и широко применяемыми в различных отраслях науки и промышленности.
1. Атомные свойства
Атомы щелочноземельных металлов имеют два электрона в валентной оболочке, что делает их очень реакционноспособными. Кроме того, эти металлы имеют наибольшую протонную и наименьшую электронную экранизацию, что приводит к высокой химической активности в реакциях.
2. Физические свойства
Один из ключевых физических характеристик щелочноземельных металлов - их низкая плотность, которая уменьшается по мере увеличения атомного номера в группе. Кроме того, металлы этой группы обладают высокой теплопроводностью и электропроводностью. Они также обладают металлическим блеском и довольно мягкие, однако,плотность увеличивается с двух химическим элементов.
3. Химические свойства
Щелочноземельные металлы реагируют со многими веществами, в том числе с кислородом, серой, галогенами и азотной кислотой. Например, реакция с серой приводит к образованию соответствующих металлических сульфидов. Эти металлы также образуют белые оксиды, которые являются хорошими основаниями и обладают щелочными свойствами.
В целом, свойства щелочноземельных металлов делают их важными в множестве применений. Реакция этих металлов с серой играет особую роль в сфере химической промышленности и может быть использована для получения различных соединений и материалов.
Атомира, физические свойства и химическая активность

Щелочноземельные металлы в химической системе представлены элементами от магния до бария. Они относятся к группе 2 периодической системы элементов и обладают общей электронной конфигурацией ns2.
Физические свойства щелочноземельных металлов включают низкую плотность, низкую температуру плавления и кипения, а также мягкость и хорошую проводимость тепла и электричества. Они обладают серебристо-белым цветом и имеют низкую твердость. Кроме того, они легко реагируют с водой и кислородом, образуя соответственно щелочные гидроксиды и оксиды.
Химическая активность щелочноземельных металлов возрастает с увеличением атомного номера. Они хорошо растворяются в воде, образуя щелочные растворы, что свидетельствует о их кислотными свойствами. Они также реагируют с серой, образуя соответствующие сульфиды. Сульфиды щелочноземельных металлов обладают различной степенью растворимости в воде.
Например, сера реагирует с магнием, образуя сульфид магния (MgS), который является бесцветным кристаллическим веществом. Бериллий реагирует с серой медленнее, образуя сульфид бериллия (BeS), который также является бесцветным. В то же время, сульфиды кальция (CaS), стронция (SrS) и бария (BaS) обладают более высокой растворимостью и имеют характерный цвет.
Способы получения щелочноземельных металлов
Щелочноземельные металлы – это группа элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они являются основными элементами второй группы периодической системы химических элементов.
Щелочноземельные металлы получают различными способами, в зависимости от их свойств и использования. Один из основных способов – восстановление оксидов металлов с помощью углерода или других редуцирующих веществ.
Например, магний получают путем термического разложения оксида магния (MgO) при повышенной температуре. При этом оксид расщепляется на металлический магний и кислород:
- MgO + C → Mg + CO
Кальций можно получить термическим способом из оксида кальция (CaO):
- CaO + C → Ca + CO
Бериллий и стронций получают восстановлением соответствующих оксидов с помощью алюминия или магния. Например, получение бериллия осуществляется следующей реакцией:
- BeO + 2Al → Al2O3 + 2Be
Барий получают путем электролиза раствора бария в расплавленных солях. Радий – самый редкий и радиоактивный из щелочноземельных металлов, его получение связано с использованием ядерных реакций и специфическими методами.
Влияние минералов на химическую активность металлов
Химическая активность металлов, в том числе и щелочноземельных, может быть существенно изменена под влиянием минералов. Минералы, содержащие различные химические элементы, могут взаимодействовать с металлами и вызывать изменения в их химических свойствах и реакциях.
Например, на химическую активность щелочноземельных металлов влияют минералы, содержащие серу. Сера может образовывать соединения с металлами, обладающие различной степенью реакционной способности. Такие соединения могут влиять на способность металла реагировать с другими веществами.
Некоторые минералы, содержащие серу, могут образовывать сложные структуры с щелочноземельными металлами, обеспечивая им устойчивость и способность к реакциям. Например, сульфаты щелочноземельных металлов обладают высокой стойкостью и могут использоваться в различных химических процессах.
Кроме того, взаимодействие металлов с минералами содержащими серу может вызывать изменения в реакционной способности этих металлов. Например, металлы могут подвергаться окислению или восстановлению в присутствии таких минералов, что приводит к изменению их окислительно-восстановительного потенциала и активности.
Реакции щелочноземельных металлов с серой
Щелочноземельные металлы, такие как магний, кальций, стронций и барий, проявляют реакции с серой при нагревании.
Магний реагирует с серой при высокой температуре, образуя магний серу:
- Магний рекомендуется нагревать в инертной атмосфере, чтобы избежать окисления металла.
- Молибден или графитовый ковш используют для проведения реакции, так как они не реагируют с серой.
- Окислители, такие как карбонат кальция или пероксид бария, помогают ускорить реакцию.
Таким образом, магний сера образуется при взаимодействии магния и серы в условиях высокой температуры и отсутствии окислителей.
Кальций реагирует с серой при нагревании с образованием кальция серы:
- Реакцию проводят в жаростойких реакционных сосудах при температуре около 800 градусов Цельсия.
- Взаимодействие кальция и серы происходит с эволюцией большого количества тепла.
- Кальций сера образуется в виде белой пыли или порошка.
Реакции магния и кальция с серой являются важными для получения соответствующих неорганических соединений и имеют промышленное значение.
Физические свойства соединений щелочноземельных металлов с серой

Соединения щелочноземельных металлов с серой обладают рядом характерных физических свойств. Прежде всего, они обычно образуются в виде твердых кристаллических веществ с высоким плавлением и кипением.
Щелочноземельные соединения с серой, такие как сульфиды, сульфаты или сульфид-сульфатные соединения, встречаются в природе в виде минералов и проявляют различные цвета и химические свойства.
Некоторые соединения щелочноземельных металлов с серой могут обладать металлическими свойствами, такими как электропроводность или магнитные свойства. Это связано с наличием ионов металлов в структуре соединений и их способностью перемещаться под влиянием электрического или магнитного поля.
Кроме того, соединения щелочноземельных металлов с серой обычно обладают высокой твердостью и хрупкостью, что связано с их кристаллической структурой и особыми связями между атомами вещества.
Изучение физических свойств соединений щелочноземельных металлов с серой позволяет более глубоко понять их химическую природу, а также применять эти свойства в различных областях науки и техники, например, в производстве полупроводников, катализаторов и материалов с определенными магнитными или электрооптическими свойствами.
Биологическая роль щелочноземельных металлов в организме

Щелочноземельные металлы, такие как магний, кальций и стронций, играют важную роль в организме человека. Они необходимы для нормального функционирования многих физиологических процессов.
Магний, наиболее известный и распространенный щелочноземельный металл, является важным компонентом многих ферментов в организме. Он участвует в синтезе белка, углеводов и нуклеиновых кислот. Также магний необходим для регуляции активности нервной системы и мышц, а также для поддержания здоровья сердца.
Кальций, еще один щелочноземельный металл, играет роль в формировании и укреплении костей и зубов. Он также участвует в сокращении мышц, передаче нервных импульсов и регуляции кровяного давления. Кальций необходим для нормального функционирования клеток и поддержания стабильности внутренней среды организма.
Стронций, щелочноземельный металл, имеет аналогичные свойства и функции кальция. Он также участвует в образовании и ремонте костной ткани, но его основное применение - в медицине, для диагностики болезней костей и суставов методом радиоизотопной диагностики.
Выводы: щелочноземельные металлы играют важную роль в организме человека, влияют на множество физиологических процессов и обеспечивают нормальное функционирование клеток, нервной системы, мышц и органов. Они являются неотъемлемой частью нашего организма и требуются для поддержания нашего здоровья.
Использование щелочноземельных металлов в индустрии

Щелочноземельные металлы, такие как магний, кальций и барий, играют важную роль в различных отраслях промышленности. Их уникальные свойства делают эти металлы незаменимыми во многих процессах производства.
Магний широко используется в автомобильной промышленности благодаря своей легкости и высокой прочности. Он является основным компонентом сплавов, используемых для производства автомобильных деталей, таких как кузовы, двигатели и шасси. Магний также применяется в производстве легких сплавов для авиационной и космической промышленности.
Кальций находит применение в производстве стали и сплавов. Он используется для десульфурации и дегазации расплавленного металла, что позволяет улучшить его качество и устойчивость к коррозии. Кальций также используется в производстве смазочных материалов, товаров бытовой химии и фармацевтических препаратов.
Барий широко применяется в процессе взаимодействия с серой для получения специализированных химических продуктов, таких как бариевые соединения, которые используются в производстве радиоактивных препаратов, пигментов и катализаторов. Барий также находит применение в производстве стекла, электроники и в медицинской диагностике.
Вопрос-ответ

Каково значение щелочноземельных металлов в химии?
Щелочноземельные металлы играют важную роль в химии. Они являются основными металлами, обладающими химическими свойствами, и часто используются в различных процессах и реакциях.
Какие свойства имеют щелочноземельные металлы?
Щелочноземельные металлы обладают рядом характерных свойств. Они имеют низкую плотность, мягкие и легко обрабатываемые, образуют ионные соединения с хлором, обладают низкой собственной электроотрицательностью и высокой электропроводностью.
Каковы реакции щелочноземельных металлов с серой?
Реакции щелочноземельных металлов с серой могут быть разными в зависимости от условий. При нагревании металла с серой образуется соответствующее металлическое сульфидное соединение. Также возможна реакция с образованием сульфонатов, которая происходит при взаимодействии щелочноземельного металла с раствором серной кислоты.
