Щелочноземельные металлы – это элементы второй группы периодической системы Д.И. Менделеева, которые используются во множестве промышленных и научных областей. Они включают бериллий, магний, кальций, стронций, барий и радий. Одной из интересных сторон их химических свойств является их взаимодействие с кислотами.
Кислоты – это химические соединения, которые в растворе образуют ион H+. Щелочноземельные металлы обладают высокой щелочностью и, следовательно, образуют с кислотами соли и водород. Это взаимодействие происходит из-за электронодонорных свойств металлов и электроакцепторной способности кислот. Более тяжелые металлы этой группы имеют большую активность в химических реакциях с кислотами.
Одним из наиболее известных примеров взаимодействия щелочноземельных металлов с кислотами является реакция металла с водой. В результате этой реакции образуется гидроксид металла и высвобождается водород. Например, реакция кальция с водой приводит к образованию гидроксида кальция и эволюции водорода:
Ca + 2H2O → Ca(OH)2 + H2
Такие реакции не только сопровождаются выделением водорода, но и сопровождаются значительным выделением тепла, что делает их использование во множестве промышленных процессов, таких как выработка энергии и производство горючих материалов.
Взаимодействие щелочноземельных металлов с кислотами

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, проявляют реактивность при взаимодействии с растворами кислот. Они способны образовывать соли и выделяться в виде газов или осадков.
Например, магний реагирует с сильными кислотами, такими как соляная кислота (HCl) или серная кислота (H2SO4), образуя хлорид магния (MgCl2) или сульфат магния (MgSO4). Во время реакции выделяется водородный газ, что можно наблюдать по характерному шипящему звуку и появлению пузырьков в растворе.
Кальций имеет более активный химический характер, чем магний, поэтому реакции с кислотами протекают более интенсивно. В результате взаимодействия кальция с соляной кислотой выделяются водородный газ и образуется хлорид кальция (CaCl2).
Стронций и барий также образуют соли при реакции с кислотами, однако они менее реактивны, чем магний и кальций. При взаимодействии со соляной кислотой они образуют соответствующие хлориды (SrCl2 и BaCl2) и выделяются газы.
В целом, взаимодействие щелочноземельных металлов с кислотами подтверждает их способность образовывать стабильные соли и проявлять реактивность в химических реакциях.
Определение щелочноземельных металлов

Щелочноземельные металлы - это группа металлов в периодической таблице элементов, которые относятся ко 2-й группе. К ним относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы имеют сходные химические свойства, такие как низкая электроотрицательность, высокая термическая и электрическая проводимость.
Бериллий является самым легким из щелочноземельных металлов и обладает высокой прочностью и жаростойкостью. Он имеет низкую плотность и используется в различных отраслях промышленности, включая авиацию и радиоэлектронику.
Магний является одним из наиболее распространенных щелочноземельных металлов и обладает высокой химической активностью. Он используется в сплавах, взрывчатых веществах, а также в производстве легких сплавов.
Кальций является существенным элементом для живых организмов, так как играет важную роль в образовании костей и зубов. Он также широко используется в строительной и металлургической промышленности.
Стронций и барий обладают схожими химическими свойствами. Стронций применяется в производстве огнетушителей, а барий - в производстве стекла и пигментов для красок.
Радий является редким и радиоактивным элементом. Он широко используется в научных и медицинских исследованиях, особенно в радиотерапии и детектировании радиоактивных веществ.
В целом, щелочноземельные металлы обладают уникальными химическими свойствами, которые делают их важными элементами в различных отраслях промышленности, медицине и науке.
Кислоты: основные понятия

Кислоты - это вещества, которые обладают способностью отдавать протоны (H+) в реакциях с другими соединениями. Они играют важную роль в химических процессах и могут быть как органическими, так и неорганическими веществами.
Коммерчески доступные кислоты обычно имеют сильные едкие свойства и обладают высокой степенью растворимости в воде. Их реактивность зависит от их структуры и концентрации. К некоторым из них относятся соляная кислота, серная кислота и азотная кислота.
Кислоты могут реагировать с основаниями, оксидами и металлами. Реакция с основанием приводит к образованию солей и воды. Реакция с оксидами может привести к образованию кислотных оксигидов, а с металлами - к образованию соответствующих солей.
Для характеристики кислотности обычно используется понятие pH, которое определяет концентрацию ионов водорода в растворе. Кислотные растворы имеют значение pH меньше 7. Чем меньше значение pH, тем более кислотный раствор.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы – это группа химических элементов, которая расположена во второй группе периодической системы. К этой группе относятся бериллий, магний, кальций, стронций, барий и радий. У этих металлов есть ряд сходных химических свойств, которые связаны с их расположением в периодической системе и структурой электронных оболочек.
Основное химическое свойство щелочноземельных металлов – их способность образовывать ионы с положительным зарядом. Это связано с тем, что у этих элементов внешний электронный слой содержит всего два электрона, что делает их электронную оболочку достаточно нестабильной. При взаимодействии с другими веществами, щелочноземельные металлы отдают эти два электрона и образуют положительные ионы. Например, бериллий вступает реакцию с кислородом, образуя ион Be2+.
Щелочноземельные металлы реагируют с большинством кислот, образуя соли и водород. Например, магний при реакции с соляной кислотой образует хлорид магния и выделяет водород. Подобные реакции возможны из-за сильной щелочности этих металлов – они обладают высокими основными свойствами.
Еще одним важным химическим свойством щелочноземельных металлов является их способность образовывать соединения с кислородом. Например, бериллий и стронций образуют оксиды BeO и SrO соответственно. Эти соединения можно использовать в разных отраслях промышленности, например, для производства керамики и стекла.
Взаимодействие щелочноземельных металлов с кислотами

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, проявляют способность реагировать с кислотами. Эта реакция основана на обмене ионами между металлом и кислотой.
При контакте с кислотой, щелочноземельные металлы образуют соли и выделяются соответствующие газы. Например, реакция магния с соляной кислотой идет следующим образом:
Mg + 2HCl → MgCl2 + H2
Соли, образующиеся в результате реакции, имеют характерные свойства щелочноземельных металлов. Они обладают высокой растворимостью в воде и образуют бесцветные или белые кристаллы. Также, соли щелочноземельных металлов хорошо растворяются в органических растворителях, таких как этанол и ацетон.
Взаимодействие щелочноземельных металлов с кислотами может быть использовано в различных химических процессах, например, для получения соединений металлов или в производстве удобрений.
Примеры реакций щелочноземельных металлов с кислотами
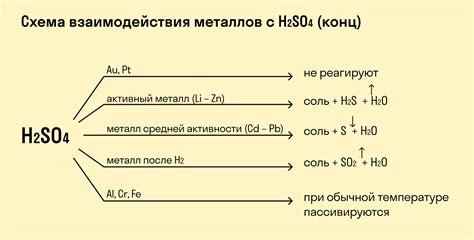
Магний (Mg) реагирует с кислотами, образуя соль и выделяя газ водород. Например, реакция магния с соляной кислотой (HCl) приводит к образованию хлорида магния (MgCl2) и выделению водорода (H2):
- Mg + 2HCl → MgCl2 + H2
Кальций (Ca) также реагирует с кислотами, образуя соль и выделяя газ водород. Например, реакция кальция с серной кислотой (H2SO4) приводит к образованию сульфата кальция (CaSO4) и выделению водорода:
- Ca + H2SO4 → CaSO4 + H2
Стронций (Sr) также реагирует с кислотами, образуя соль и выделяя газ водород. Например, реакция стронция с азотной кислотой (HNO3) приводит к образованию нитрата стронция (Sr(NO3)2) и выделению водорода:
- Sr + 2HNO3 → Sr(NO3)2 + H2
Барий (Ba) также реагирует с кислотами, образуя соль и выделяя газ водород. Например, реакция бария с фосфорной кислотой (H3PO4) приводит к образованию фосфата бария (Ba3(PO4)2) и выделению водорода:
- 3Ba + 2H3PO4 → Ba3(PO4)2 + 3H2
Вопрос-ответ

Какие химические свойства имеют щелочноземельные металлы при взаимодействии с кислотами?
Щелочноземельные металлы, такие как магний, кальций, стронций и барий, обладают химическими свойствами при взаимодействии с кислотами. Они реагируют с кислотами, образуя соль и выделяя водород. При этой реакции образуется хлорид, сульфат, ацетат или другой соли щелочноземельного металла, а также образуется молекула воды.
Какие особенности можно выделить в химических свойствах щелочноземельных металлов при взаимодействии с кислотами?
Щелочноземельные металлы проявляют несколько особенностей при взаимодействии с кислотами. Во-первых, они реагируют с кислотами, но образуют сложные ионы вместо простых солей. Например, магний, взаимодействуя с серной кислотой, образует сульфатный ион. Во-вторых, реакция между щелочноземельными металлами и кислотами протекает с выделением газа - водорода. Это является отличительной чертой от реакции щелочных металлов с кислотами, где в результате образуется соль и выделяется водород. И наконец, кислоты, взаимодействуя с щелочноземельными металлами, образуют растворимые соли, которые обычно не осаждается из раствора.
