Щелочноземельные металлы – это группа элементов периодической системы, которая включает в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают схожими химическими свойствами и образуют двойные сплавы, оксиды и соли.
Барий – щелочноземельный металл, находится вторым в группе щелочноземельных элементов после кальция. В природе барий встречается в виде ряда минералов, таких как барит (свинцовая руда), ваниадинит, церуссит и др. Он химически активен и способен образовывать соединения с различными элементами.
Химические свойства бария определяют его способность образовывать двухзарядные положительные ионы (Ba2+), что делает его сильным окислителем. Он реагирует с кислородом, азотом, серой и другими неметаллами, а также с некоторыми органическими соединениями. Барий может образовывать соединения с хлором, бромом, йодом и с кислотными оксидами.
Одним из основных соединений бария является гидроксид бария (Ba(OH)2), который образуется при взаимодействии бария с водой. Этот соединение обладает щелочными свойствами и может использоваться в различных химических процессах.
Химические свойства кальция

Атомный номер: 20
Атомная масса: 40,078 г/моль
Электронная конфигурация: [Ar] 4s2
Кальций (Ca) является щелочноземельным металлом и вторым элементом во втором периоде периодической таблицы. Он имеет атомный номер 20 и относится к группе 2 периодической таблицы. Кальций обладает химическими свойствами, такими как высокая реактивность и способность образовывать соединения с различными элементами.
Кислотность: Кальций реагирует с водой, образуя гидроксид кальция и выделяя водород. Реакция с водой нестабильна и легко разлагается под воздействием влаги и кислорода. Гидроксид кальция обладает щелочными свойствами и используется в производстве щелочей и веществ, необходимых для обработки отходов.
Окисление: Кальций обладает высокой способностью к окислению, особенно при нагревании. Он реагирует с кислородом и прочими окислителями, образуя оксид кальция (CaO), который широко используется в производстве цемента и стекла.
Способность образовывать соединения: Кальций образует множество соединений с различными элементами. Самое известное соединение - кальцийкарбонат (CaCO3), известный как мрамор, известняк и аренит. Кальций также образует соединения с другими металлами, такими как железо, алюминий и магний.
Применение: Кальций широко используется в различных областях, таких как производство стекла, цемента, металлургия, сельское хозяйство и медицина. Он может быть использован в качестве добавки к пищевым продуктам и витаминам, а также в производстве лекарственных препаратов.
Химические свойства стронция

Стронций - щелочноземельный металл с атомным номером 38 и атомной массой 87,62 г/моль. Он относится к группе 2 периодической системы элементов и имеет химические свойства, характерные для металлов, в основном щелочноземельных.
Стронций обладает высокой реакционной способностью и легко вступает в реакции с водой, кислородом и галогенами. Он образует оксид SrO, который реагирует с водой, образуя щелочь стронциевую и Sr(OH)2. Растворы стронциевой щелочи имеют щелочную реакцию и способны реагировать с кислотами, образуя соли стронция.
Стронций образует соединения с различными кислотами, образуя соли стронция. Например, стронций реагирует с серной кислотой, образуя сульфат стронция (SrSO4), который является нерастворимым в воде. Соль стронция используется в медицине для рентгеновского обследования органов и тканей человека.
Стронций образует также азотнокислые соли, бикарбонат стронция (Sr(HCO3)2), нитрат стронция (Sr(NO3)2) и многочисленные другие соединения. В комплексах соединений стронция и его оксидов, стронций может быть различными валентностями, как +2, так и +3.
Стронций обладает ярко-красной фотолюминесценцией, что делает его полезным материалом в производстве люминофоров для радиолюминисцентных часов, ксеноновых ламп и телевизионных экранов.
Химические свойства бария
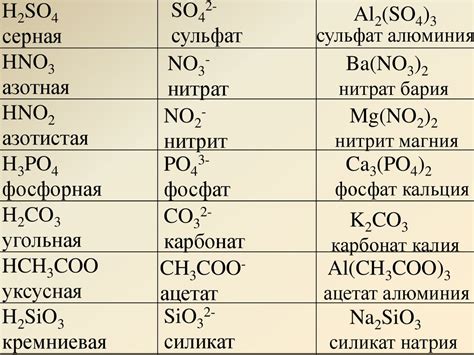
1. Химическая активность: Барий относится к химически активным металлам. Взаимодействуя с водой и воздухом, барий образует различные соединения, такие как оксид бария (BaO), гидроксид бария (Ba(OH)2) и нитрат бария (Ba(NO3)2).
2. Реакция с кислотами: Барий образует соли с различными кислотами. Например, при реакции с соляной кислотой образуется хлорид бария (BaCl2), который широко используется в лабораторных и промышленных процессах.
3. Фламмабельность: Барий сам по себе не горит, однако его соединения могут быть воспламеняемыми. Некоторые бариевые соединения, такие как нитрат бария и хлорат бария, обладают свойствами окислителей и могут поддерживать горение.
4. Токсичность: Барий и его соединения являются ядовитыми. При попадании в организм, они могут вызывать отравление, воздействие на нервную систему и нарушение работы сердца.
5. Способность к образованию отложений: Барий имеет способность образовывать отложения в технических системах, связанных с использованием бариевых соединений. Это может приводить к плохой эффективности работы системы и необходимости регулярной очистки.
6. Практическое применение: Барий широко используется в различных отраслях промышленности, включая производство стекла, электроники, нефтяной и горнодобывающей промышленности. Кроме того, барий используется в медицине для рентгенологических исследований, так как его соединения являются хорошими поглотителями рентгеновского излучения.
Сравнение химических свойств щелочноземельных металлов с барием

Щелочноземельные металлы являются элементами второй группы периодической таблицы и включают в себя бериллий, магний, кальций, стронций, барий и радий. В данном сравнении особое внимание уделяется химическим свойствам бария.
Барий обладает высокой реакционной способностью и способен образовывать соединения с различными кислотами. Он реагирует с водой, образуя щелочное гидроксидное соединение, что является типичным свойством всех щелочноземельных металлов.
Одним из отличительных свойств бария является его способность образовывать растворимые соединения с серой и кислородом. Например, барий образует растворимый сульфат, который находит применение в аналитической химии для детектирования серы.
Оксид бария, BaO, является типичным основанием и может реагировать с кислотами, образуя соли. Это свойство также характерно для других щелочноземельных металлов. Однако, барийсодержащие соли могут обладать яркими поглощающими свойствами, что используется в процессе анализа и диагностики.
Сравнивая химические свойства бария с остальными щелочноземельными металлами, можно отметить, что барий обладает большей реакционной способностью и способен образовывать растворимые соединения с серой и кислородом. Эти особенности делают его важным элементом в различных областях, включая аналитическую и органическую химию.
Вопрос-ответ

Какие химические свойства имеют щелочноземельные металлы с барием?
Щелочноземельные металлы, включая барий, обладают следующими химическими свойствами: они очень реактивны, легко реагируют с водой, образуя гидроксиды, а также способны давать соединения с кислородом, серой и галогенами.
Какие соединения образуются при реакции щелочноземельного металла с барием и кислородом?
При реакции щелочноземельного металла с барием и кислородом образуются соединения, такие как оксиды и пероксиды. Например, при реакции бария с кислородом образуется бария оксид (BaO).
