Кальций - один из самых распространенных щелочноземельных металлов, который обладает рядом уникальных химических свойств. Он находится во множестве природных минералов, таких как мел, а также является неотъемлемым компонентом костей и зубов человека.
Одно из основных химических свойств кальция - его реакционная способность. Кальций активно реагирует с водой, выделяясь в виде водорода и образуя гидроксид кальция. Эта реакция является хорошим иллюстрированием его металлической природы и способности образовывать щелочные растворы.
Кроме того, кальций проявляет свойства амфотерного оксида, то есть может реагировать как с кислотами, так и с щелочами. С водными растворами он образует щелочи, а с кислотами - соответствующие соли и воду. Это свойство делает кальций важным компонентом во многих химических процессах и предоставляет ему широкое поле применения.
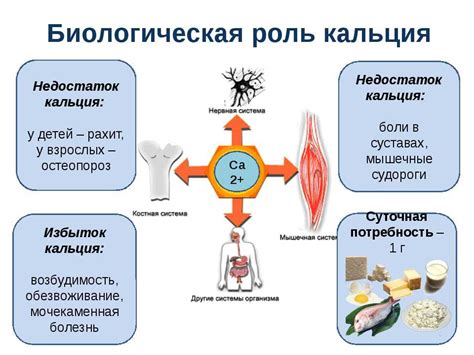
Интересно, что кальций играет ключевую роль в множестве биологических процессов. Он участвует в передаче нервных импульсов, сокращении мышц, синтезе ДНК и РНК. Кроме того, кальций является необходимым элементом для поддержания здоровья костей и зубов, а его недостаток может привести к заболеваниям, таким как остеопороз и остеомаляция.
Таким образом, химические свойства кальция делают его важным элементом как в натуральных, так и в живых системах. Исследование этих свойств позволяет лучше понять роль кальция в природе и биологии, а также находить новые способы использования этого металла в различных областях науки и промышленности.
Исследование химических свойств кальция

Кальций (Ca) - это химический элемент периодической системы, относящийся к щелочноземельным металлам. Его атомный номер равен 20, а атомная масса - около 40 единиц. Кальций является одним из наиболее распространенных элементов в земной коре и обладает множеством интересных химических свойств.
Одним из основных свойств кальция является его реактивность с водой. Когда кусок кальция погружается в воду, происходит быстрая реакция, в результате которой выделяется водородный газ и образуется щелочное растворимое вещество - гидроксид кальция. Реакция с водой вызвана высокой активностью кальция и его стремлением заполнить свою внешнюю электронную оболочку, отдавая два электрона.
Кальций также обладает способностью реагировать с кислородом. При нагревании воздуха на присутствии кальция происходит горение с ярким пламенем, в результате которого образуется оксид кальция. Эта реакция используется в различных промышленных процессах, например, при получении цемента.
Важно отметить, что кальций является необходимым элементом для живых организмов, включая человека. Он играет важную роль в образовании и поддержании костной ткани, а также участвует в многих биохимических процессах в организме. Недостаток кальция может привести к различным заболеваниям, включая остеопороз.
В заключение, исследование химических свойств кальция позволяет лучше понять его роль и значение в природе и живых организмах. Знание этих свойств также помогает в разработке и улучшении различных технологических процессов, основанных на взаимодействии с этим важным элементом.
Щелочноземельные металлы: особенности и применение

Щелочноземельные металлы - группа элементов в периодической системе, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы обладают рядом общих свойств и имеют важное применение в различных отраслях науки и промышленности.
Одной из особенностей щелочноземельных металлов является их высокая реактивность. Они легко вступают в химические реакции, особенно с кислородом и водой. Это позволяет применять их в различных процессах синтеза и производства разных веществ.
Кальций, например, широко используется в производстве стали и алюминия. Он применяется также в процессе производства сплавов, стекла и цемента. Кальция также является необходимым элементом для живых организмов, входит в состав костей и зубов, а также необходим для правильного функционирования нервной системы и сердца.
В промышленности магний применяется для производства алюминия, легких сплавов, магниевых солей и многих других веществ. Бериллий используется в производстве ядерных реакторов и рентгеновских трубок, благодаря своим уникальным свойствам.
Щелочноземельные металлы также широко применяются в медицине, в производстве лекарственных препаратов и добавок к пище. Некоторые из этих металлов имеют важное значение для нормального функционирования организма и профилактики различных заболеваний.
В целом, щелочноземельные металлы имеют широкий спектр применения и являются неотъемлемой частью современной промышленности и науки. Благодаря своим химическим свойствам и особенностям, они нашли применение во множестве отраслей и продолжают быть предметом интереса для исследователей и ученых.
Физические свойства кальция

Кальций – металл, относящийся к группе щелочноземельных элементов. Он обладает рядом уникальных физических свойств, которые делают его широкоиспользуемым и значимым в различных областях науки и промышленности.
Атомный радиус: Кальций имеет малый атомный радиус, что делает его компактным и способствует его высокой электроотрицательности.
Температура плавления: Кальций имеет низкую температуру плавления, составляющую около 842 °C, что позволяет легко перевести его из твердого состояния в жидкое.
Температура кипения: Кальций кипит при высоких температурах, около 1484 °C. Это позволяет использовать его в высокотемпературных процессах и системах.
Плотность: Кальций обладает высокой плотностью, составляющей около 1,55 г/см³. Это делает его одним из самых плотных металлов, что придает ему хорошую механическую прочность и устойчивость.
Цвет и блеск: Кальций обладает серебристо-белым цветом и металлическим блеском. Эти свойства делают его привлекательным для использования в ювелирных изделиях и декоративных элементах.
Проводимость: Кальций является хорошим проводником электричества и тепла благодаря своей высокой электропроводности и теплопроводности.
Относительная мягкость: Кальций является относительно мягким металлом, что позволяет его легко обрабатывать и формовать в различные изделия.
Ионизационный потенциал: Кальций имеет низкий ионизационный потенциал, что делает его легко ионизирующимся и способным образовывать положительные ионы при взаимодействии с другими веществами.
Реакционная способность: Кальций обладает сильной реакционной способностью, особенно с водой и кислотами, что позволяет использовать его в различных химических процессах.
Окисление и коррозия: Кальций имеет высокую стремление окисляться и подвергаться коррозии при взаимодействии с воздухом и влагой. Поэтому он обычно хранится в непроницаемых контейнерах или покрывается защитным слоем для предотвращения окисления.
Химические свойства кальция и их применение

Кальций (Ca) - один из самых распространенных элементов в земной коре и важный щелочноземельный металл. Он обладает несколькими химическими свойствами, которые делают его полезным как в промышленности, так и в жизни человека.
Кальций является активным элементом, способным быстро реагировать с водой и кислородом. Он оказывает щелочные свойства и образует оксид кальция (CaO), который широко используется в строительстве, стекольной и цементной промышленности.
Кальций также является важным компонентом многих минералов и органических соединений. Например, он составляет основу костей и зубов, где образует кальцийфосфат и кальцийкарбонат. Кальцийфосфат используется в производстве лекарственных препаратов, а кальцийкарбонат - в производстве красок, пластмасс и прочих материалов. Кальций также играет важную роль в нервной системе, мышцах и секреции гормонов.
Из-за своих химических свойств кальций широко применяется в различных отраслях промышленности. Он используется в металлургии для получения слитков и сплавов, а также в производстве стали и алюминия. Кальций также используется в производстве керамики, стекла, керамических электролитов и других материалов.
Кальций имеет также применение в сельском хозяйстве, где применяется вместе с фосфором и азотом в виде удобрений для повышения плодородия почвы. Кроме того, кальций используется в производстве пищевых добавок, таких как кальция глюконат, которые обогащают продукты питания и способствуют здоровому росту и развитию организма.
В целом, химические свойства кальция делают его важным элементом в промышленности, медицине, сельском хозяйстве и других областях жизни. Он играет важную роль в поддержании здоровья человека и обеспечении возможности проведения различных процессов и реакций.
Исследование изотопного состава кальция и его роль в науке
Исследование изотопного состава кальция является важной задачей в современной науке. Кальций является щелочноземельным металлом, чьи свойства сильно зависят от состава его изотопов. Известно, что в природе существуют шесть изотопов кальция - Ca-40, Ca-42, Ca-43, Ca-44, Ca-46 и Ca-48.
Исследование изотопного состава кальция неразрывно связано с исследованиями геологических и астрофизических процессов. Путем анализа изотопного состава кальция возможно получение важной информации о формировании и эволюции различных объектов - от земной коры до звезд и галактик. Помимо этого, изотопный анализ кальция широко применяется в изотопной геохимии, астрофизике и биологии.
Исследование изотопного состава кальция позволяет определить его происхождение и транспортные процессы в окружающей среде. Например, анализ изотопов кальция в археологических находках может помочь в установлении места происхождения изделий или в определении миграции древних народов. Кроме того, изучение изотопного состава кальция в организмах животных и растений может дать представление о питательном состоянии и условиях окружающей среды.
Вопрос-ответ

Какие химические свойства имеет кальций?
Кальций - щелочноземельный металл с атомным номером 20. У него высокая реакционность, что обусловлено его положением в периодической системе элементов. Кальций активно реагирует с кислородом, образуя оксид кальция (известный как известь) и с азотом, образуя нитрид кальция. Кальций также сильно реагирует с водой, выделяя водород. Как большинство металлов, кальций способен образовывать ионы положительной зарядности.
Какие вещества могут образовываться при реакции кальция с другими элементами?
При реакции кальция с кислородом образуется оксид кальция (CaO), также известный как известь. При взаимодействии с азотом кальций образует нитрид кальция (Ca3N2). С водой кальций реагирует, образуя гидроксид кальция (Ca(OH)2) и выделяя водород. Также кальций может образовывать соли с различными кислотами.
Каковы применения кальция в промышленности?
Кальций широко используется в промышленности благодаря своим химическим свойствам. Он применяется при производстве стали и чугуна, так как снижает их плавление, улучшает текучесть и снижает образование газов. Кальций также используется в процессах очистки воды, в производстве строительных материалов, стекла, цемента, шампуней и др. Кальций и его соединения также применяются в медицине, в качестве добавок в пищу и для укрепления костей.
Какие опасности может представлять кальций?
Кальций является относительно безопасным элементом, но при неправильном обращении с ним могут возникать опасности. Кальций пожароопасен при взаимодействии с водой, так как выделяется водород, который может образовывать взрывоопасные смеси с воздухом. Также при попадании кальция на кожу или слизистые оболочки может произойти ожог. Не рекомендуется вдыхать пыль или пары кальция, так как они могут вызвать раздражение дыхательных путей. Поэтому при работе с кальцием необходимо соблюдать соответствующие меры безопасности.
