Металлы являются одним из основных классов химических элементов, и их свойства и реакции имеют огромное значение в различных областях науки и техники. Химические свойства металлов определяются их структурой, атомной и электронной структурой, а также особыми химическими связями, называемыми металлическими связями.
Основные принципы химических свойств металлов заключаются в их способности терять электроны и образовывать положительно заряженные ионы. Это объясняет их высокую реакционную способность и способность образовывать соединения с другими элементами. Простые вещества металлов обычно обладают высокой тепло- и электропроводностью, а также хорошей плотностью и твердостью.
Основные реакции металлов включают образование основных окислов, образование амфотерных окислов, образование солей, превращение из металлов в соединения. Также металлы могут претерпевать реакции с кислородом, кислотами и щелочами. Реакции металлов часто сопровождаются выделением тепла и выделением газов.
Химические свойства и реакции простых веществ металлов

Металлы – это важная группа химических элементов, обладающих специфическими свойствами и широким спектром применений. Одной из основных характеристик металлов является их тенденция к образованию соединений через окисление. Химические реакции, которые протекают с участием металлов, часто включают в себя образование ионов металла и сопутствующую энергетическую перестройку.
Металлы способны реагировать со многими веществами, их реактивность зависит от свойств самого металла и условий реакции. Например, большинство металлов, включая щелочные металлы, легко реагируют с кислородом воздуха, образуя оксиды, такие как оксид натрия (Na2O) или оксид железа (Fe2O3). Однако некоторые металлы, например золото и платина, химически очень инертны и практически не вступают в реакции с другими веществами.
Металлы также проявляют активность при реакции с различными кислотами. Некоторые металлы, такие как магний и цинк, могут реагировать с кислотами, образуя соли и выделяя водородный газ. Например, магний реагирует с соляной кислотой (HCl) и образует соль хлорида магния (MgCl2) и молекулы водорода (H2). Это реакция активного металла с кислотой.
Металлы также могут реагировать с веществами, содержащими кислород, например, окислителями. Некоторые металлы, такие как алюминий и магний, способны реагировать с кислородом, образуя оксиды металла. Например, алюминий может реагировать с кислородом, образуя оксид алюминия (Al2O3), который обладает высокой степенью термической стабильности.
Металлы: определение, основные характеристики, важность в жизни человека
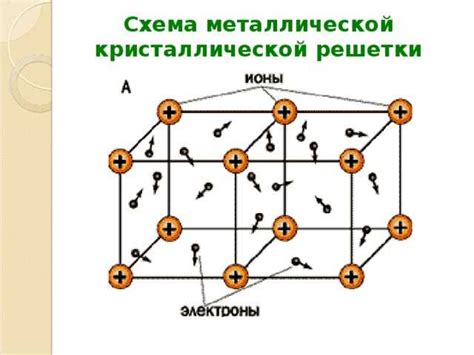
Металлы - это химические элементы, обладающие определенными свойствами, такими как высокая теплопроводность и электропроводность, способность образовывать ионные соединения и прочность.
Основные характеристики металлов включают их блеск, хорошую пластичность и деформируемость, а также эффект электролитического окисления и восстановления. Они обладают малыми электрическими сопротивлениями и высокими магнитными свойствами.
Металлы являются важным элементом в жизни человека. Они используются в различных отраслях промышленности, включая строительство, производство автомобилей, медицину и электронику.
Металлы, такие как железо и алюминий, используются для строительных конструкций, производства машин и инструментов. Медь и алюминий используются для проводов и кабелей, благодаря своей высокой электропроводности.
В медицине металлы используются для создания имплантатов, зубных протезов и инструментов. Например, титановые имплантаты часто используются при замене суставов.
Они также играют важную роль в электронике. Металлы, такие как золото, серебро и медь, используются в производстве контактов, проводов и компонентов электронных устройств.
Таким образом, металлы являются неотъемлемой частью нашей жизни и имеют огромное значение в промышленности, медицине и электронике, благодаря своим уникальным химическим и физическим свойствам.
Электрохимические свойства металлов: активность, реакция с водой и кислотами
Электрохимические свойства металлов определяют их способность образовывать ионные соединения и вступать в электрохимические реакции. Одной из основных характеристик этих свойств является активность металла. Активность металлов определяется их способностью участвовать в реакциях окисления-восстановления.
Металлы могут вступать в реакции с водой и кислотами. Реакция с водой часто происходит в присутствии кислорода воздуха. Самые активные металлы, такие как калий и натрий, реагируют с водой с выделением водорода и образованием щелочи. Некоторые металлы, такие как алюминий и цинк, реагируют с водой только при нагревании или при наличии кислорода.
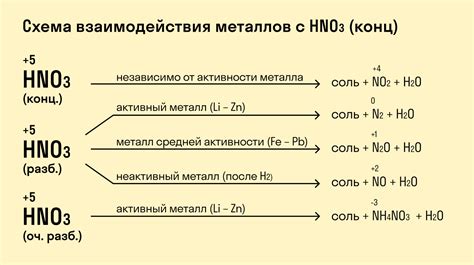
Реакция металлов с кислотами также является электрохимической реакцией. Металлы, обладающие высокой активностью, реагируют с кислотами, выделяя водород и образуя соли металлов. Например, цинк реагирует с соляной кислотой при выделении водорода и образовании хлорида цинка. Более низкоактивные металлы, такие как медь и серебро, не реагируют с обычными кислотами, но могут реагировать с сильными оксидирующими кислотами, такими как концентрированный азотная или серная кислоты.
Таблица активности металлов, известная как ряд напряжений, позволяет сравнить активности различных металлов. В таблице металлы располагаются по убывающей активности. Металлы, находящиеся выше в ряду, обладают большей активностью и легко вступают в реакции с водой и кислотами. Это позволяет использовать ряд напряжений при определении возможности проведения электрохимической реакции.
Окислительно-восстановительные свойства металлов: принцип действия, примеры реакций

Окислительно-восстановительные свойства металлов – это их способность к участию в химических реакциях, при которых происходит перенос электронов с одного вещества на другое. Это свойство проявляется благодаря наличию внешней оболочки, содержащей свободные электроны, которые могут быть переданы другим веществам.
Принцип действия окислительно-восстановительных свойств металлов основан на двух ключевых понятиях – окислении и восстановлении. В химической реакции окисление происходит при потере электрона, а восстановление – при его приобретении. Металлические элементы обладают способностью отдавать электроны, окисляясь до положительного иона, и принимать электроны, восстанавливаясь до нейтрального состояния.
Примеры реакций с участием окислительно-восстановительных свойств металлов включают реакцию цинка с кислотой. При взаимодействии цинка (Zn) с разбавленной соляной кислотой (HCl) образуется ион цинка (Zn2+) и водород (H2). В этой реакции цинк окисляется, отдавая два электрона, которые переходят на ионы водорода, восстанавливая их до молекулярного состояния.
Еще одним примером реакции с участием окислительно-восстановительных свойств металлов является горение магния. При нагревании магниевого порошка (Mg) с образованием кислорода (O2) происходит окисление металла, при котором он теряет электроны и превращается в магниевый ион (Mg2+). Кислород, в свою очередь, восстанавливается, принимая электроны от магния. Нагревание магния продолжается в результате экзотермической реакции между оксидом магния (MgO) и металлическим магнием (Mg).
Таким образом, окислительно-восстановительные свойства металлов играют важную роль в химических реакциях и могут быть использованы для различных практических целей, включая производство сплавов, электрическую проводимость и каталитические процессы.
Металлы в качестве катализаторов: механизмы реакций и их практическое применение
Металлы могут использоваться в химических реакциях в качестве катализаторов, то есть веществ, которые ускоряют химическую реакцию, но не участвуют в ней безвозвратно. Это связано с тем, что металлы обладают определенными химическими свойствами, которые позволяют им вступать во взаимодействие с реагентами и образовывать промежуточные соединения, активируя реакцию.
Механизмы каталитических реакций с участием металлов могут быть различными в зависимости от конкретной реакции. Однако, существуют основные принципы, которые применимы к большинству каталитических реакций с участием металлов. Эти принципы включают активацию реагентов на поверхности металла, диффузию реакционных промежуточных соединений и рекомбинацию реагентов для образования конечного продукта.
Металлические катализаторы имеют широкое практическое применение в различных отраслях промышленности. Например, платина, никель, родий и другие металлы используются в процессе каталитического крекинга нефти для производства бензина. Также, металлы часто применяются в качестве катализаторов в процессах окисления или восстановления, синтеза органических соединений и других химических преобразованиях.
Использование металлов в роли катализаторов позволяет значительно повысить скорость химических реакций и снизить энергозатраты. Благодаря этому, процессы, которые без катализаторов могли бы занимать много времени или требовать высоких температур и давлений, могут быть проведены эффективно и экономично. Кроме того, открытие новых металлических катализаторов и изучение их механизмов реакций помогает разрабатывать новые методы синтеза и улучшать существующие процессы в химической промышленности.
Термические свойства металлов: плавление, испарение, нагреваемость

Металлы обладают различными термическими свойствами, которые определяют их поведение при нагревании. Одним из таких свойств является плавление - процесс перехода металла из твердого в жидкое состояние при достижении определенной температуры. Каждый металл имеет свою точку плавления, которая зависит от его структуры и химического состава.
Испарение - это процесс перехода металла из жидкого в газообразное состояние при достижении определенной температуры. Точка испарения металла может быть выше или ниже его точки плавления, и также зависит от его свойств. Испарение металлов может быть использовано для получения чистых металлических паров, которые затем могут быть конденсированы и использованы для различных целей.
Нагреваемость металлов - это способность металлов быстро нагреваться при подводе энергии в виде тепла. Она зависит от многих факторов, включая теплоемкость и теплопроводность материала. Нагреваемость металлов может быть использована, например, для нагрева металлических предметов до нужной рабочей температуры или для проведения различных термических реакций и процессов.
Термические свойства металлов являются важной характеристикой при их использовании в различных областях науки и промышленности. Знание этих свойств позволяет контролировать и оптимизировать процессы нагревания, плавления и испарения металлов в соответствии с требованиями конкретной задачи или проекта.
Взаимодействие металлов с неметаллами: образование химических соединений

Металлы и неметаллы могут взаимодействовать, образуя химические соединения. Эти соединения обладают различными свойствами и имеют важное практическое применение. В процессе взаимодействия металлов с неметаллами происходит обмен электронами, что приводит к образованию ионов и образцов с новыми химическими свойствами.
Образование химических соединений между металлами и неметаллами определяется тем, какие ионы могут образовываться в процессе реакции. Некоторые металлы имеют свойство образовывать положительно заряженные ионы - катионы, тогда как неметаллы часто образуют отрицательно заряженные ионы - анионы.
Образование химических соединений между металлами и неметаллами может происходить по различным схемам. Например, металл может отдать электрон(ы) неметаллу, образуя положительно заряженный катион и отрицательно заряженный анион. Это может произойти, например, при реакции натрия с хлором, где натрий отдает один электрон хлору, образуя катион Na+ и анион Cl-.
Взаимодействие металлов с неметаллами может проходить и по другим схемам. Например, образование химических соединений может происходить при обмене ионами - катионами и анионами с образованием солей. Кроме того, существуют и другие сложные взаимодействия, например, образование соединений с использованием органических неметаллов, таких как углерод.
Комплексообразующие свойства металлов: способы образования комплексов и их свойства

Металлы обладают уникальными свойствами, позволяющими им образовывать комплексы с другими веществами. Комплексообразование – это процесс образования комплексных соединений, в которых металл образует связь с лигандами – молекулами или ионами, которые обычно являются неорганическими соединениями или органическими соединениями, содержащими атомы химических элементов, отличных от металла.
Существует несколько способов образования комплексов металлов. Один из них – образование комплексов в реакциях простых солей с соответствующими лигандами. Этот процесс основан на принципе образования новых химических связей между металлом и лигандом.
Комплексные соединения металлов обладают рядом уникальных свойств. Во-первых, комплексы металлов обычно имеют более высокую стабильность по сравнению с простыми солями. Это означает, что комплексы менее склонны к разложению и обеспечивают более длительное существование. Во-вторых, комплексные соединения часто обладают разнообразными физическими и химическими свойствами, такими как цветность, магнитные или каталитические свойства.
Комплексообразующие свойства металлов играют важную роль во многих областях химии, таких как катализ, лекарственная химия и координационная химия. Понимание принципов образования комплексов и изучение их свойств позволяет эффективно использовать металлы в синтезе новых соединений и создании новых материалов с определенными функциональными свойствами.
Металлы в органической химии: реакции с органическими соединениями и их применение

Металлы в органической химии играют важную роль, так как они могут участвовать в реакциях с органическими соединениями. Эти реакции позволяют получать новые органические соединения с различными свойствами и применениями.
Одной из наиболее распространенных реакций металлов с органическими соединениями является реакция металлов с органическими кислотами. В результате таких реакций образуется соль металла и соответствующий органический продукт. Например, реакция цинка с уксусной кислотой дает ацетат цинка.
Реакции металлов с органическими соединениями также могут приводить к образованию органических производных металлов. Например, реакция бромида магния с этиленом может привести к образованию этилендибромида.
Использование металлов в органической химии имеет множество применений. Например, органические соединения металлов могут использоваться в качестве катализаторов для проведения различных химических реакций. Также органические комплексы металлов могут использоваться в медицине для лечения различных заболеваний, так как они обладают определенными фармакологическими свойствами.
Вопрос-ответ

Какие основные свойства и реакции простых веществ металлов существуют?
Основные свойства и реакции простых веществ металлов включают реакцию с водой, кислотами и кислотными оксидами, окисление металлов, образование солей, взаимодействие металлов с аммиаком и хлоридами, а также гальваническую коррозию металлов.
Что происходит при реакции металлов с водой?
При реакции металлов с водой обычно образуются металлические гидроксиды и выделяется водород. Реактивность металлов с водой может различаться: некоторые металлы, такие как натрий и калий, реагируют очень активно, тогда как другие металлы, например цинк или железо, реагируют медленно или вообще не реагируют.
Что происходит при взаимодействии металлов с кислотами и кислотными оксидами?
При взаимодействии металлов с кислотами и кислотными оксидами образуются соли и выделяется водород. Металлы активной серии, такие как натрий или калий, реагируют с различными кислотами, например соляной или серной кислотой. Менее реактивные металлы, такие как медь или свинец, не реагируют с кислотами.
Можно ли металлы окислить и какие реакции происходят при окислении?
Да, металлы могут быть окислены воздухом или другими веществами. Например, железо окисляется под воздействием кислорода из воздуха и образует ржавчину. Окисление металлов протекает в окислительно-восстановительных реакциях, в результате которых металл теряет электроны и превращается в ион.
