Оксиды щелочных металлов - это химические соединения, которые образуются в результате реакции щелочных металлов с кислородом. Они обладают рядом уникальных химических свойств, которые делают их важными компонентами во многих процессах и применениях.
Оксиды щелочных металлов обычно имеют общую формулу MO, где M представляет собой элемент группы щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и др. В результате их реакции с кислородом образуется оксид, который обладает особыми свойствами и способностями.
Одним из основных свойств оксидов щелочных металлов является их щелочность. При растворении в воде оксиды щелочных металлов образуют гидроксиды, которые обладают щелочной средой. Они реагируют с кислотами, образуя соли и воду. Это свойство делает их важными ингредиентами в различных производственных процессах, включая производство стекла и мыла.
Другим интересным свойством оксидов щелочных металлов является их реакционная способность. Они могут взаимодействовать с другими химическими веществами, образуя новые соединения. Например, оксид натрия (Na2O) может реагировать с водой, образуя гидроксид натрия (NaOH) - промышленно важное вещество, используемое в различных отраслях промышленности.
Определение основных оксидов

Основные оксиды - это соединения, образующиеся при соединении металлов и кислорода. Они являются основами сильных кислот и могут образовываться металлами с положительными электропотенциалами. Главная особенность основных оксидов - их способность взаимодействовать с кислородными кислотами и образовывать соли.
Основные оксиды обладают базическими свойствами, то есть они способны реагировать с водой и образовывать гидроксиды - сильные основания. В результате реакции металлов с кислородом образуется оксид, который может быть твердым, жидким или газообразным. Основные оксиды имеют металлический или полуметаллический характер.
Определение основного оксида возможно по его составу и химическим свойствам. Они обычно образуются при окислении металлов и легко реагируют с кислотами. К ним относятся такие вещества, как оксид натрия, оксид калия, оксид кальция и другие. Их химические формулы имеют вид MeO (где Me - символ металла).
Свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом уникальных химических свойств, которые делают их одними из самых реактивных и активных элементов.
Прежде всего, щелочные металлы хорошо растворяются в воде. При этом они проявляют сильную щелочность и реагируют с водой, образуя гидроксиды, что обусловило их название. Реакция между щелочным металлом и водой сопровождается выделением водорода и образованием щелочного раствора. Например, натрий взаимодействует с водой, образуя гидроксид натрия и высвобождая водородный газ:
2Na + 2H2O → 2NaOH + H2↑
Другим важным свойством щелочных металлов является их способность образовывать ионы с положительным зарядом. Они легко отдают один электрон, образуя одновалентные ионы: Li+, Na+, K+, Rb+, Cs+. Это обуславливает их высокую химическую реактивность и способность образовывать соединения с различными веществами.
Также следует отметить, что щелочные металлы имеют низкую плотность, что делает их легкими и хорошо плавающими на воде. Однако, из-за высокой реактивности, они не встречаются в природе в свободном состоянии, а только в виде соединений. Кроме того, щелочные металлы обладают высокой теплопроводностью и электропроводностью, что делает их важными компонентами в различных технологических процессах.
- литий (Li),
- натрий (Na),
- калий (K),
- рубидий (Rb),
- цезий (Cs) и
- франций (Fr).
Реакции основных оксидов с водой

Основные оксиды щелочных металлов относятся к классу соединений, которые обладают выраженными щелочными свойствами. При прямом взаимодействии с водой они образуют соответствующие гидроксиды, в результате чего происходит щелочная реакция. Реакции основных оксидов с водой сопровождаются образованием щелочей и выделением тепла.
Например, реакция натриевого оксида (Na2O) с водой протекает по следующему уравнению:
Na2O + H2O → 2NaOH
Полученный гидроксид натрия - NaOH является сильной щелочью. Подобную реакцию можно наблюдать и с другими основными оксидами, такими как оксид калия (K2O) и оксид гидроксида бария (BaO).
Таблица ниже показывает некоторые распространенные основные оксиды щелочных металлов и их соответствующие гидроксиды:
| Оксид | Гидроксид |
|---|---|
| Na2O | NaOH |
| K2O | KOH |
| Li2O | LiOH |
| BaO | Ba(OH)2 |
Такие реакции являются важными процессами в химической промышленности и используются, например, для производства гидроксида натрия – основного компонента многих бытовых моющих средств.
Окислительные свойства основных оксидов

Основные оксиды, получающиеся в результате соединения щелочных металлов с кислородом, обладают сильными окислительными свойствами. Они активно взаимодействуют с веществами, обладающими возможностью вступать в окислительные реакции.
Окислительные свойства основных оксидов проявляются в их способности отбирать электроны от других веществ и самостоятельно восстанавливаться. В результате окисления оксидов происходят реакции, в которых электроны переходят от оксида к другому веществу. Таким образом, основные оксиды совершают химические реакции с восстановлением себя.
Окислительные свойства основных оксидов приводят к тому, что они способны окислять различные вещества. Например, основные оксиды щелочных металлов могут окислять металлы, образуя при этом металлические оксиды и соли. Также они могут вступать в реакции с нетерпением и серной кислотой, образуя соответствующие соли. Способность основных оксидов окислять и взаимодействовать с различными соединениями делает их важными веществами во многих химических процессах.
Взаимодействие основных оксидов с кислотами
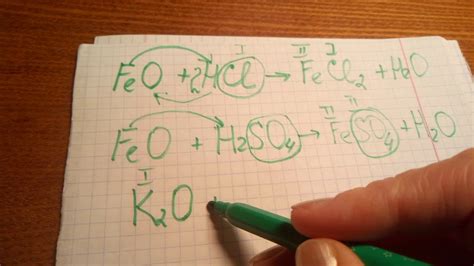
Основные оксиды, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид гидроксида (Li2O), обладают выраженными основными свойствами и активно взаимодействуют с кислотами.
В результате взаимодействия основных оксидов со сильными кислотами образуются соли и вода. Например, реакция между оксидом натрия и хлороводородной кислотой (HCl) приводит к образованию хлорида натрия (NaCl) и воды:
- Na2O + 2HCl → 2NaCl + H2O
Также основные оксиды могут реагировать с слабыми кислотами, образуя соли и воду. Например, реакция между оксидом калия и уксусной кислотой (CH3COOH) приводит к образованию ацетата калия (CH3COOK) и воды:
- K2O + 2CH3COOH → 2CH3COOK + H2O
Взаимодействие основных оксидов с кислотами является одним из способов получения солей. Это реакции нейтрализации, при которых ионы гидроксидов основных оксидов реагируют с ионами водорода кислот, образуя молекулы воды и соли. При этом свойства основных оксидов проявляются в их способности реагировать с кислотами и изменять свою химическую структуру.
Получение основных оксидов

Основные оксиды щелочных металлов получаются в результате реакции соответствующего металла с кислородом. Реакцию можно проводить различными способами, включая нагревание металла в кислородной среде, окисление металла в присутствии сильного окислителя или распад перекиси щелочного металла.
При нагревании металла в кислородной среде происходит соединение металла с кислородом, образуя основный оксид. Например, при нагревании натрия в кислороде получается оксид натрия (Na2O).
Окисление металла в присутствии сильного окислителя также приводит к образованию основного оксида. Например, при окислении калия водным раствором хлора образуется оксид калия (K2O).
Распад перекиси щелочного металла также может привести к образованию основного оксида. Например, при распаде перекиси натрия образуется оксид натрия (Na2O).
Применение основных оксидов

Основные оксиды – это соединения, получаемые в результате реакции щелочных металлов с кислородом. Интересно, что эти соединения широко применяются в разных отраслях нашей жизни.
В первую очередь основные оксиды используются в производстве основных растворов. Благодаря своей щелочной природе, они способны нейтрализовать кислоты и устранять кислотное отравление. Кроме того, основные оксиды используются в производстве моющих средств, так как они обладают высокой щелочной активностью и хорошо отмывают загрязнения.
Еще одна важная область применения основных оксидов – это стекольная промышленность. Они добавляются в смесь при производстве различных видов стекла. Кроме того, основные оксиды используются при получении различных цветных стекол, так как они способны вносить изменения в оптические свойства материала.
Основные оксиды также находят применение в металлургии и гальванике. Они используются для получения металлических покрытий на различных поверхностях. Это обусловлено их способностью вступать в реакцию с различными металлами и образовывать устойчивые соединения.
В общем, основные оксиды являются важными химическими соединениями, которые находят широкое применение в различных отраслях промышленности и научных исследованиях. Их щелочная активность и способность реагировать с различными веществами делают их ценными ингредиентами в многих процессах и производствах.
Вопрос-ответ

Чем определяется химическое свойство основных оксидов щелочных металлов?
Химическое свойство основных оксидов щелочных металлов определяется их способностью образовывать основания при реакции с водой. Они проявляют себя как основатели, образуя гидроксиды или гидраты гидроксидов щелочных металлов, увеличивая концентрацию гидроксидных ионов в растворе.
Какие свойства имеют оксиды щелочных металлов и чем они обусловлены?
Оксиды щелочных металлов обычно обладают щелочными свойствами, то есть они реагируют с водой, образуя гидроксиды. Это свойство обусловлено тем, что щелочные металлы образуют оксиды с отрицательным зарядом и высокой электроотрицательностью. Это позволяет им легко взаимодействовать с положительно заряженными ионами гидроксила (OH-), образуя основания.
Какие реакции характерны для основных оксидов щелочных металлов?
Основные оксиды щелочных металлов обычно реагируют с водой, образуя гидроксиды. Например, реакцией оксида натрия (Na2О) с водой образуется гидроксид натрия (NaOH). Также основные оксиды могут реагировать с кислотами, образуя соль и воду.
