Основания щелочных металлов являются одними из наиболее распространенных химических соединений. В основном они состоят из ионов щелочных металлов и гидроксидных ионов. Интересным фактом является то, что основания щелочных металлов образуются путем реакции щелочного металла с водой, в результате чего образуется гидроксид металла.
Химические свойства оснований щелочных металлов проявляются при реакциях с кислотами и другими соединениями. Они обладают высокой основностью и могут нейтрализовать кислоты, образуя соль и воду. Также основания щелочных металлов обладают способностью образовывать с растворимыми металлическими солями комплексные соединения, что является одним из их важных применений в химической промышленности.
Интересно отметить, что основания щелочных металлов также используются в процессе обезвреживания опасных отходов и очистки воды, так как они способны превращать токсичные вещества в менее опасные соединения.
Благодаря своим химическим свойствам основания щелочных металлов широко применяются в различных отраслях промышленности. Например, гидроксид натрия используется в производстве стекла, мыла и моющих средств, а гидроксид калия применяется при изготовлении удобрений и в производстве катализаторов. Также основания щелочных металлов широко применяются в лабораторных условиях для регулирования pH растворов и проведения различных химических экспериментов.
Химические свойства оснований щелочных металлов
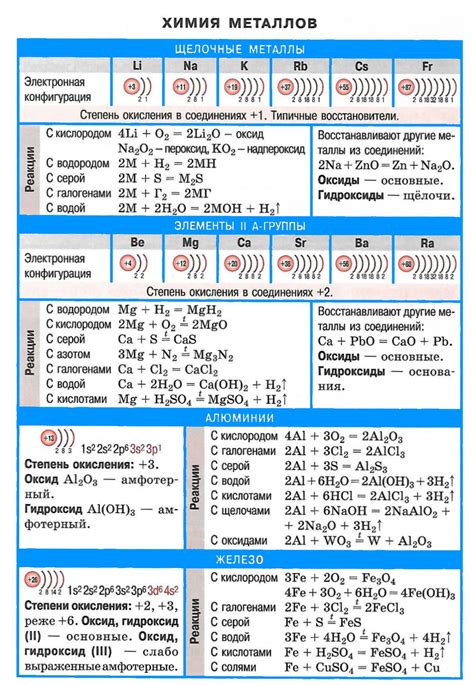
Щелочные металлы представляют собой группу химических элементов, включающую в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым активным элементам в периодической системе и проявляют характерные свойства оснований.
Основания щелочных металлов обладают рядом уникальных свойств. Во-первых, они растворяются в воде, образуя щелочные растворы. Это объясняется тем, что они обладают высокой аффинностью к воде и способностью образовывать ионные связи с водными молекулами.
Во-вторых, основания щелочных металлов обладают амфотерными свойствами. Они могут реагировать как с кислотами, так и с кислотными оксидами, образуя соли и воду. Это позволяет им широко применяться в химической промышленности и лабораторных исследованиях.
Основания щелочных металлов также обладают сильными восстановительными свойствами. Они способны принимать на себя электроны, что позволяет им быть использованными в процессе восстановительных реакций. Этот факт также находит применение в различных отраслях наук, включая электрохимию и металлургию.
Важно отметить, что химические свойства оснований щелочных металлов могут различаться в зависимости от конкретного элемента. Например, литий проявляет более высокую химическую активность, чем остальные щелочные металлы, в то время как франций является наиболее реактивным элементом из группы.
Определение и классификация оснований

Основания - это вещества, которые при реакции с водой образуют гидроксиды и ионы гидроксида. Гидроксиды щелочных металлов относятся к типу оснований, которые растворяются в воде и образуют щелочные растворы.
Основания можно классифицировать на несколько групп в зависимости от состава и свойств. Классификация оснований основывается на количестве гидроксильных ионов в молекуле основания.
Металлические основания - это основания, состоящие только из металла и гидроксильного иона (OH-). Примерами металлических оснований являются NaOH (гидроксид натрия) и KOH (гидроксид калия).
Основания с кислотным водородом - это основания, содержащие кислород и гидроксильный ион OH-, а также один или более атомов водорода, способных активно взаимодействовать с кислотами. Примером основания с кислотным водородом является NH4OH (аммиак).
Гидроксиды - это основания, в которых гидроксильный ион (OH-) является главным компонентом. Гидроксиды, такие как Ca(OH)2 (гидроксид кальция) и Ba(OH)2 (гидроксид бария), обладают щелочными свойствами и широко используются в промышленности и научных исследованиях.
Реакции оснований щелочных металлов с кислотами:
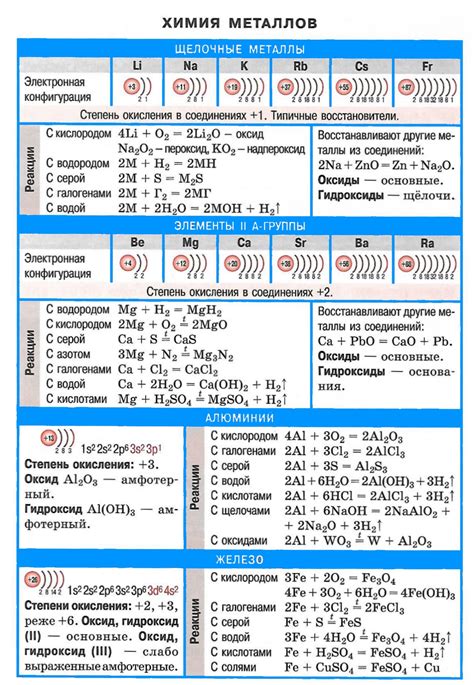
Основания щелочных металлов активно реагируют с кислотами, образуя соли и воду. Такие реакции происходят по принципу обмена протонами, где основание отдает OH- и получает H+, который присоединяется к атомам кислорода в кислоте. При этом образуются соответствующие соли с ионами щелочного металла и ионами аниона из кислоты.
Например, реакция между щелочным гидроксидом и кислотой соляной выглядит следующим образом:
NaOH + HCl → NaCl + H2O
В результате реакции образуется хлорид натрия и вода. Известно, что щелочные металлы образуют максимально растворимые соли, поэтому реакция между основанием щелочного металла и кислотой происходит безопасно и без выделения газов.
Реакции между основаниями щелочных металлов и кислотами широко применяются в химической промышленности, медицине и повседневной жизни. Они используются для получения солей и воды, а также в качестве нейтрализаторов при обработке отходов и очистке водных растворов от кислот. Кроме того, основания щелочных металлов находят применение в производстве мыла, стекла и многих других химических продуктов.
Особенности свойств оснований щелочных металлов

Основания щелочных металлов, таких как литий, натрий, калий и др., обладают рядом уникальных свойств, которые делают их неотъемлемой частью множества химических реакций и применений.
- Высокая щелочность: основания щелочных металлов обладают сильной щелочностью, что позволяет им образовывать гидроксиды, которые в щелочной среде растворяются и оказывают ряд полезных свойств.
- Химическая реактивность: щелочные металлы легко вступают в реакцию с кислотами и другими веществами, образуя соли и воду. Это позволяет им использоваться в процессах нейтрализации и регулирования pH в различных отраслях промышленности.
- Ионизация: основания щелочных металлов образуют ионы гидроксида (OH-), которые являются основными компонентами растворов этих веществ. Это позволяет использовать основания щелочных металлов в качестве электролитов и катализаторов в различных химических процессах.
Основания щелочных металлов также находят применение в производстве мыла, стекла, удобрений и других продуктов. Помимо этого, они являются важными активаторами множества ферментных реакций в организмах живых существ и участвуют в регулировании метаболических процессов.
Базность и щелочность оснований

Основания являются важной группой химических соединений, обладающих базными свойствами. Они относятся к категории растворимых в воде веществ, которые образуют гидроксиды щелочных металлов. Базность оснований проявляется в их способности принимать протоны, обладать амфотерными свойствами и способностью образовывать соли.
Основания щелочных металлов, такие как гидроксиды натрия, калия и других, широко применяются в различных сферах человеческой деятельности. Они используются в производстве стекла, мыла, моющих средств, в пищевой промышленности, фармацевтике и многих других отраслях. Базность оснований щелочных металлов делает их незаменимыми компонентами для множества процессов и реакций.
Щелочные металлы, такие как литий, натрий, калий и другие, обладают самой высокой щелочностью среди всех элементов периодической системы. Их основания образуют наиболее сильные растворы щелочных соединений. Благодаря этой особенности, основания щелочных металлов активно применяются в медицине для нейтрализации кислотной среды, в железнодорожной промышленности для поддержания безопасности при перевозке опасных грузов, а также в производстве удобрений для регулирования кислотности почвы.
Восстановительные свойства оснований

Основания щелочных металлов обладают выраженными восстановительными свойствами, которые определяются наличием свободных электронов во внешней оболочке атомов. Это позволяет им легко отдавать электроны и восстанавливать другие химические вещества. При взаимодействии с окислителями основания превращаются сами в окислители.
Примечательно, что восстановительные свойства оснований щелочных металлов усиливаются с увеличением атомного радиуса. Это связано с тем, что больший размер атому позволяет иметь более слабое притяжение к электрону, что упрощает процесс его отрыва.
Восстановительные свойства оснований широко используются в различных областях химии и промышленности:
- Основания щелочных металлов применяются в процессе электролиза для восстановления металлов из их соединений.
- Они используются в производстве сплавов и литейных материалов.
- Основания щелочных металлов широко применяются в стекольной промышленности для придания стеклу особого состава и свойств.
- Они также используются в качестве редукторов и катализаторов в различных химических реакциях.
Таким образом, восстановительные свойства оснований щелочных металлов играют важную роль в множестве процессов и применений, заслуживая внимания и детального изучения в области химии и химической промышленности.
Применение оснований щелочных металлов

Основания щелочных металлов имеют широкое применение в различных сферах науки и промышленности. Во-первых, они используются в химической промышленности для производства различных соединений и продуктов. Например, основания щелочных металлов широко применяются в качестве катализаторов, которые ускоряют химические реакции и повышают выход продукции.
Основания щелочных металлов также активно используются в процессе водоочистки и очистки отходов. Они обладают высокой реакционной способностью и способны эффективно нейтрализовывать кислотные вещества. Поэтому их часто добавляют в процессы очистки воды, воздуха и промышленных сточных вод.
Кроме того, основания щелочных металлов являются важными компонентами в производстве стекла, мыла и моющих средств. Они придают продуктам определенные свойства, такие как мягкость, обладание большей пеной или силой смыва. Благодаря своим химическим свойствам, основания щелочных металлов становятся неотъемлемой частью производства таких товаров, как шампуни, моющие порошки и моющие жидкости.
Другим важным применением оснований щелочных металлов является использование их в процессе синтеза органических соединений. Основания щелочных металлов играют роль щелочных катализаторов в реакциях синтеза сложных органических веществ. Они способствуют ускорению реакции и повышению ее эффективности при получении различных органических соединений, включая фармацевтические препараты и пищевые добавки.
Вопрос-ответ

Какие основные особенности химических свойств щелочных металлов?
Щелочные металлы, такие как литий, натрий, калий и другие, обладают рядом характерных особенностей. Они обладают высокой активностью, легко окисляются воздухом и реагируют с водой, выделяя горючий водород. Щелочные металлы также образуют сильные основания, которые растворяются в воде, образуя щелочные растворы.
В чем состоит применение оснований щелочных металлов?
Основания щелочных металлов находят широкое применение в различных областях. Например, гидроксид натрия, известный как каустическая сода, используется в промышленности при производстве стекла, мыла и многих других продуктов. Кроме того, основания щелочных металлов используются в химической лаборатории для регулирования pH растворов, а также в медицине для нейтрализации кислотности желудочного сока.
