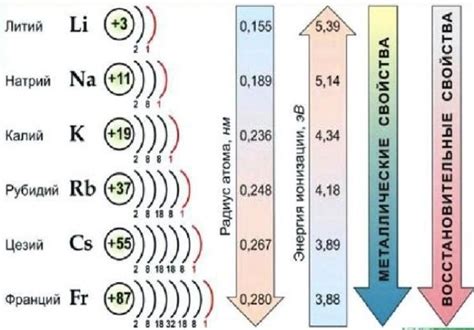
Щелочные металлы – это элементы первой группы периодической системы Менделеева, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реакционной способностью и являются источниками оснований. Щелочные металлы образуют стабильные положительные ионы, которые характеризуются малой полярностью и большими радиусами. Это делает их идеальными для реакций с водой, кислотами и другими веществами.
Одним из характерных свойств щелочных металлов является способность реагировать с водой. При взаимодействии с водой они образуют гидроксиды и выделяются водород. Первые три щелочных металла (Li, Na, K) проводят данную реакцию очень быстро и с большим выделением тепла. Это связано с тем, что образующиеся ионы гидроксида имеют большую реакционную способность.
Еще одним важным свойством щелочных металлов является их реакция с кислотами. Учитывая, что щелочные металлы являются сильными основаниями, они могут реагировать с различными кислотами, образуя соответствующие соли и выделяя воду. Такие реакции широко применяются в химическом производстве и в лабораторных условиях.
Помимо реакций с водой и кислотами, щелочные металлы также взаимодействуют с другими веществами, например, с оксидами и галогенами. Это свойство дает возможность использовать щелочные металлы в различных областях, таких как производство сплавов, стекла, а также в батареях и других электрических устройствах.
Химические свойства щелочных металлов

Щелочные металлы - это группа элементов, которые находятся на первой группе периодической таблицы. Они включают литий, натрий, калий, рубидий, цезий и франций. У этих металлов есть некоторые общие химические свойства, связанные с их реактивностью и способностью образовывать основания кислот.
Щелочные металлы характеризуются высокой реактивностью, что обусловлено наличием одной электронной оболочки с одним валентным электроном. Они легко вступают в реакции с водой, кислородом и другими веществами. Например, при контакте с водой они образуют щелочное растворение, которое обладает щелочными свойствами.
Щелочные металлы также способны образовывать стабильные одновалентные и многовалентные ионы, например Na+ и Na2+. Они образуют стабильные ионы с отрицательным зарядом путем передачи своих валентных электронов. Эта способность обусловлена низкой энергией ионизации и высокой электроотрицательностью щелочных металлов, что позволяет им легко отдавать электроны.
Щелочные металлы обладают реакционной способностью исключительных оснований. Они реагируют с кислотами, образуя соль и высвобождая воду. Эта реакция называется нейтрализацией. Реакция щелочных металлов с кислотами происходит образованием ионов металла и ионов аниона из кислоты.
Например:
2Na + 2HCl → 2NaCl + H2
Таким образом, химические свойства щелочных металлов включают высокую реактивность, способность образовывать стабильные ионы с различным зарядом, и они являются сильными основаниями в реакциях с кислотами. Эти свойства делают щелочные металлы важными элементами в химической промышленности и медицине, а также предоставляют основу для понимания ряда химических процессов.
Воспламенение щелочных металлов на воздухе
Щелочные металлы (натрий, калий, рубидий, цезий) обладают такими свойствами, что их реакция с воздухом протекает с образованием пламени. Это связано с тем, что щелочные металлы обладают высокой реакционной способностью и они могут вступать в химические реакции с кислородом из воздуха. Как правило, воспламенение щелочных металлов происходит сначала при контакте с кислородом, а затем самовозгорается.
При взаимодействии с воздухом, щелочные металлы сначала образуют оксиды, а затем так называемые пепели. Оксиды щелочных металлов обладают свойствами основ, они растворяются в воде и образуют щелочные растворы.
Пепели щелочных металлов распространяются по воздуху и могут вызывать серьезные ожоги на коже и дыхательных путях. Поэтому при работе с щелочными металлами необходимо соблюдать осторожность и работать со специальной защитной одеждой и средствами индивидуальной защиты.
- Пепели щелочных металлов представляют опасность для окружающей среды, так как они могут загрязнять почву и воду.
- При взаимодействии щелочных металлов с водой образуется водород, который может образовывать взрывоопасные смеси.
- Огонь, вызываемый щелочными металлами, трудно потушить обычными средствами пожаротушения, поэтому для ликвидации пламени используют специальные огнетушители.
Таким образом, воспламенение щелочных металлов на воздухе является опасным явлением, требующим соблюдения мер предосторожности и использования специальных средств для ликвидации пламени.
Реакция щелочных металлов с водой

Щелочные металлы, такие как литий, натрий и калий, проявляют активность при реакции с водой. Это связано с их электрохимическими свойствами и высокой реакционной способностью. Реакция щелочных металлов с водой происходит с выделением водорода и образованием щелочных растворов.
В процессе реакции щелочного металла с водой образуется гидроксид металла и освобождается водород. Образование гидроксида металла возникает благодаря обратимой реакции шелушения воды металлом:
- 2M + 2H2O → 2MOH + H2
Гидроксиды щелочных металлов являются сильными основаниями и, в зависимости от концентрации, могут обладать различной щелочностью. Например, раствор гидроксида натрия будет иметь щелочную среду со значительным pH, тогда как раствор гидроксида лития будет иметь более слабое воздействие на pH.
Реакции щелочных металлов с водой сильно эндотермические, то есть они поглощают тепло из окружающей среды. Это приводит к образованию энергичных огневых явлений, таких как искры и пламя при контакте щелочного металла с водой.
Образование оснований кислот щелочными металлами

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, обладают высокой щелочностью и способностью реагировать с кислотами. В результате таких реакций образуются основания кислот.
Образование оснований кислот щелочными металлами происходит путем замещения водорода в молекуле кислоты. В результате реакции образуются соли и вода. Например, при взаимодействии щелочного металла натрия (Na) с кислотой соляной (HCl) образуется соль натрия (NaCl) и вода (H2O):
2Na + 2HCl → 2NaCl + H2O
Основания, образованные щелочными металлами, обладают высокой щелочностью и обычно имеют сильно щелочную реакцию в водных растворах. Они могут нейтрализовать кислоты и служить базой в различных химических реакциях.
В реакции с водой щелочные металлы разрушают молекулы воды, образуя гидроксиды щелочных металлов. Например, при реакции натрия (Na) с водой образуется гидроксид натрия (NaOH) и выделяется водород:
2Na + 2H2O → 2NaOH + H2
Таким образом, щелочные металлы способны образовывать основания кислот путем замещения водорода в молекулах кислоты. Образующиеся основания обладают высокой щелочностью и активностью в химических реакциях.
Способы получения щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются одними из наиболее реактивных элементов. Они обладают сильными основными свойствами и широко используются в различных областях науки и промышленности.
Одним из способов получения щелочных металлов является электролиз плавящихся солей. Для этого в качестве электролита обычно используют смесь хлористого или фтористого натрия или калия с хлористым лития. При проведении электролиза, в результате окислительно-восстановительных реакций, на катоде осаждается металл, а на аноде выделяется хлор или фтор. Полученный щелочный металл может быть отделен от электролита и применен в дальнейшем.
Вторым способом получения щелочных металлов является термическое восстановление соответствующих оксидов металлов. Для этого оксиды щелочных металлов подвергают воздействию высоких температур в течение определенного времени. В результате происходит отделение кислорода и образование металлического металла. Такой способ получения широко используется при производстве лития и натрия.
Третьим способом получения щелочных металлов является обработка соответствующих хлоридов водородом. Например, для получения лития, хлорид лития нагревают с хлороводородом до температуры, при которой происходит реакция отделения металла. В результате получается металлический литий, который может быть подвергнут дальнейшей очистке и использован в различных областях науки и промышленности.
Вопрос-ответ

Какие химические свойства характерны для щелочных металлов?
Щелочные металлы, такие как литий, натрий, калий и другие, обладают свойствами, характерными для металлов: они хорошие проводники электричества и тепла, имеют малую твердость и плотность. Однако их главное химическое свойство заключается в том, что они с легкостью образуют положительные ионы, отдавая свой внешний электрон. Это делает их мощными редукторами.
Каковы основания кислот, образованные щелочными металлами?
Щелочные металлы образуют оксиды и гидроксиды, которые являются основаниями. Оксиды щелочных металлов обычно имеют формулу M2O, где М представляет собой щелочный металл. Например, оксид лития имеет формулу Li2O. Гидроксиды щелочных металлов имеют формулу МОН, где М представляет собой щелочный металл. Например, гидроксид натрия имеет формулу NaOH.
Почему щелочные металлы считаются сильными основаниями?
Щелочные металлы считаются сильными основаниями благодаря своей способности образовывать гидроксиды, которые хорошо диссоциируются в воде, образуя ионы гидроксида (ОН-). Ионы гидроксида являются сильно основными и способны нейтрализовать кислоту. Гидроксиды щелочных металлов обладают высоким pH и обладают щелочными свойствами.
