Оксиды щелочных металлов - это неорганические соединения, состоящие из щелочных металлов и кислорода. Они обладают широкими химическими свойствами и играют важную роль в различных отраслях науки и промышленности.
Один из ключевых аспектов химических свойств оксидов щелочных металлов - это их реакционная способность. Взаимодействуя с различными веществами, оксиды щелочных металлов образуют разнообразные соединения.
Примером реакции образования соединения является реакция между оксидом натрия (Na2O) и водой. При этом образуется щелочь (натриевая гидроксидная) NaOH. Данная реакция имеет большое практическое значение, поскольку натриевая гидроксидная щелочь является основным продуктом промышленного производства щелочей.
Оксиды щелочных металлов также могут реагировать с кислотами, образуя соли и воду. Например, реакция между оксидом калия (K2O) и соляной кислотой (HCl) приводит к образованию хлорида калия (KCl) и воды (H2O).
Химические свойства оксидов щелочных металлов имеют большое значение в различных отраслях науки и промышленности. Изучение этих свойств помогает разрабатывать новые методы получения важных соединений и развивать различные технологии производства.
Учебная статья о химических свойствах оксидов щелочных металлов

Оксиды щелочных металлов представляют собой химические соединения, которые образуются в результате реакции щелочных металлов с кислородом. Они имеют важное значение в химии и широко используются в различных процессах и промышленных производствах.
Химические свойства оксидов щелочных металлов определяют их способность реагировать с другими веществами. Например, оксид натрия, Na2O, сильно гигроскопичен и может вызывать раздражение кожи и слизистых оболочек. Кроме того, оксид натрия может реагировать с водой, образуя щелочь.
Реакция оксидов щелочных металлов с кислотами также играет важную роль. Например, оксид калия, K2O, способен образовывать сульфат калия, K2SO4, в результате реакции с серной кислотой. Эта реакция широко применяется в производстве удобрений и в сельском хозяйстве для обеспечения растений необходимыми питательными веществами.
Оксиды щелочных металлов также могут реагировать с более сложными соединениями. Например, оксид калия может реагировать с оксидами неметаллов, такими как оксид углерода, CO2, образуя углекислый калий, K2CO3. Это вещество широко используется в химической промышленности и в производстве стекла.
В заключение, химические свойства оксидов щелочных металлов являются наиболее значимыми и полезными. Они играют важную роль в различных производствах и процессах, а также имеют применение в различных сферах науки и техники.
Вещества и свойства щелочных металлов

Щелочные металлы – это группа элементов периодической системы, которые включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они характеризуются низкой плотностью, низкой температурой плавления и высокой химической активностью.
Литий - наименее плотный и самый легкий металл. Он используется в производстве аккумуляторных батарей, сплавов, лекарств и других химических соединений.
Натрий - металл серебристо-белого цвета. Он входит в состав множества химических соединений и используется в пищевой и стекольной промышленностях, а также в производстве кожи и мыла.
Калий - мягкий металл с серебристо-белым оттенком. Он широко применяется в сельском хозяйстве как удобрение, а также в производстве стекла, мыла и других продуктов.
Рубидий - металл с ярко-красным оттенком. Он используется в научных исследованиях, в производстве фотоэлементов и специальных стекол, а также в ядерном энергетическом производстве.
Цезий - самый реактивный щелочной металл. Он находит применение в производстве электронных приборов, фотоэлементов и вакуумных труб, а также в научных исследованиях.
Щелочные металлы обладают высокой активностью, проявляющейся в реакциях с кислородом и водой. Они быстро окисляются на воздухе и образуют оксиды, нитриды и гидроксиды. Примеры реакций включают горение лития в кислороде, образование гидроксида натрия при его взаимодействии с водой, а также реакцию цезия с кислородом, при которой образуется оксид цезия.
Значение свойств щелочных металлов заключается в их широком применении в различных областях промышленности, науке и медицине. Их соединения используются как катализаторы, удобрения, полупроводники и многое другое. Благодаря своей активности, щелочные металлы - важные компоненты для производства многих продуктов, обеспечивая электронику и другие отрасли современного общества.
Оксиды щелочных металлов: структура и состав
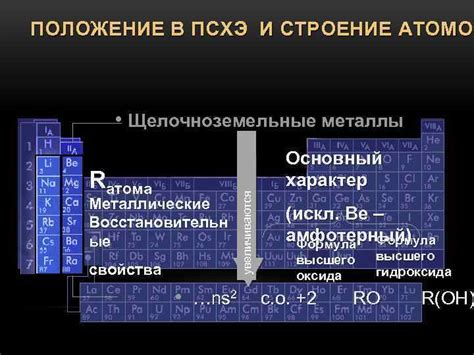
Оксиды щелочных металлов представляют собой соединения, содержащие один атом щелочного металла и одну или несколько групп окислительных кислородов. Структура оксидов щелочных металлов обычно является ионно-кристаллической и включает металлические катионы и анионы оксида. Кристаллическая решетка оксидов щелочных металлов обладает высокой стабильностью и регулярной геометрией.
Состав оксидов щелочных металлов зависит от их формулы, которая определяется числом атомов металла и кислорода. Например, оксид лития имеет формулу Li2O, а оксид калия - K2O. Оксиды щелочных металлов обычно являются более основными, чем кислотные оксиды, так как щелочные металлы обладают свойством образовывать ионы гидроксида в растворе. Следовательно, оксиды щелочных металлов могут реагировать с водой, образуя щелочи.
Оксиды щелочных металлов играют важную роль во многих химических реакциях и применяются в различных областях, включая промышленность, металлургию и бытовую химию. Они используются в производстве стекла, керамики, щелочных аккумуляторов и других электрохимических устройств. Также оксиды щелочных металлов применяются в лабораторных исследованиях и в процессе синтеза различных химических соединений.
Взаимодействие оксидов щелочных металлов с водой

Оксиды щелочных металлов оказывают сильное воздействие на воду. При контакте с водой, оксиды щелочных металлов образуют соответствующие гидроксиды и выделяются большие количества тепла. Эта реакция является экзотермической и сопровождается выделением значительного количества энергии.
Примером такой реакции может служить взаимодействие оксида натрия (Na2O) с водой:
2Na2O + 2H2O → 4NaOH
В результате этой реакции образуется гидроксид натрия (NaOH) и выделяется большое количество тепла. Образовавшийся гидроксид натрия является щелочью и обладает выраженной щелочной реакцией.
Подобным образом взаимодействуют с водой и другие оксиды щелочных металлов. Например, оксид калия (K2O) при контакте с водой образует гидроксид калия (KOH) и выделяет тепло. Аналогичные реакции наблюдаются и с оксидами других щелочных металлов, таких как литий, рубидий и цезий.
Реакции оксидов щелочных металлов с кислотами и основаниями

Оксиды щелочных металлов представляют собой соединения, получаемые в результате окисления элементов группы I периодической системы. Они обладают выраженными щелочными свойствами, проявляющимися при реакциях с кислотами и основаниями.
Реакция оксидов щелочных металлов с кислотами приводит к образованию солей и воды. Например, оксид натрия (Na2O) взаимодействует с соляной кислотой (HCl) с образованием хлорида натрия (NaCl) и воды:
2Na2O + 2HCl → 2NaCl + H2O
Реакция оксидов щелочных металлов с основаниями также приводит к образованию солей и воды. Например, оксид калия (K2O) реагирует с натриевым гидроксидом (NaOH) с образованием гидроксида калия (KOH) и натрия (Na2O):
K2O + 2NaOH → KOH + Na2O
Таким образом, реакции оксидов щелочных металлов с кислотами и основаниями являются основой для получения солей и воды, их значения заключаются в их роль в химических превращениях и использовании в различных производственных процессах.
Значение и использование оксидов щелочных металлов в промышленности и научных исследованиях

Оксиды щелочных металлов, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O), имеют важное значение в промышленности и научных исследованиях.
Они широко используются в качестве основного сырья при производстве стекла. Получаемые из них растворы натрия, калия и лития обладают высокой щелочностью и способностью растворять кремний, что позволяет использовать их в стекольной промышленности для производства различных видов стекла, включая окна, посуду и оптические приборы.
Кроме того, оксиды щелочных металлов используются в процессе производства керамики и эмалей. Они играют роль связующего материала, способного образовывать прочную связь между частицами, что позволяет создавать структуры с высокой прочностью и стабильностью.
Оксиды щелочных металлов также находят применение в качестве катализаторов в различных химических реакциях. Они способны активировать реакцию окисления или редукции, ускоряя химические процессы.
Благодаря своим уникальным свойствам, оксиды щелочных металлов часто являются объектом научных исследований. Исследователи стремятся понять их структуру и свойства, а также разработать новые технологии использования в различных отраслях промышленности.
Вопрос-ответ

Какие реакции могут происходить с оксидами щелочных металлов?
Оксиды щелочных металлов реагируют с водой, с кислородом, аммиаком, кислотами, а также образуют соли и гидроксиды.
Каким образом оксиды щелочных металлов взаимодействуют с водой?
При реакции с водой оксиды щелочных металлов образуют гидроксиды. Например, оксид натрия (Na2O) с водой образует гидроксид натрия (NaOH).
Как происходит реакция оксидов щелочных металлов с кислородом?
Оксиды щелочных металлов окисляются кислородом, образуя пероксиды. Например, оксид калия (K2O) с кислородом образует пероксид калия (K2O2).
Какие реакции могут происходить с оксидами натрия и калия?
Оксиды натрия (Na2O) и калия (K2O) могут реагировать с водой, образуя гидроксиды. Они также реагируют с кислородом, образуя пероксиды. Кроме того, они могут реагировать с кислотами и аммиаком, образуя соли и соответствующие аминокомплексы.
Каково значение реакций оксидов щелочных металлов?
Реакции оксидов щелочных металлов имеют большое значение в промышленности и научных исследованиях. Гидроксиды щелочных металлов широко используются в химической промышленности, в бытовых и косметических продуктах, а также в производстве стекла и щелочных аккумуляторов. Реакции с кислородом позволяют получать пероксиды, которые применяются в медицине и в производстве окислителей. Реакции с кислотами, водой и аммиаком используются в химическом анализе и синтезе соединений.
