Оксиды металлов являются химическими соединениями металлов с кислородом. Они широко распространены в природе и имеют разнообразные свойства. Таблица оксидов металлов позволяет систематизировать эти соединения и изучить их особенности.
Свойства оксидов металлов определяются различными факторами, включая химическую природу металла, его степень окисления, степень кристалличности соединения и другие факторы. Оксиды металлов могут быть кислотными, основными или амфотерными в зависимости от их реакции с водой и кислотами.
Таблица оксидов металлов представляет собой систематический перечень оксидов различных металлов. В таблице указывается формула каждого оксида, его название, степень окисления металла и тип реакции с водой и кислотами. Также в таблице можно найти информацию о физических свойствах соединений, таких как цвет, состояние (твердое, газообразное), температура плавления и кипения и другие параметры.
Химические особенности оксидов металлов связаны с их способностью проводить электрический ток, реагировать с другими химическими веществами и протекать разнообразные реакции. Оксиды металлов являются важными компонентами в различных процессах, таких как окислительные реакции, синтез веществ и химический анализ. Изучение и понимание свойств оксидов металлов имеет значительное значение в химической науке и промышленности.
Таблица свойств оксидов металлов
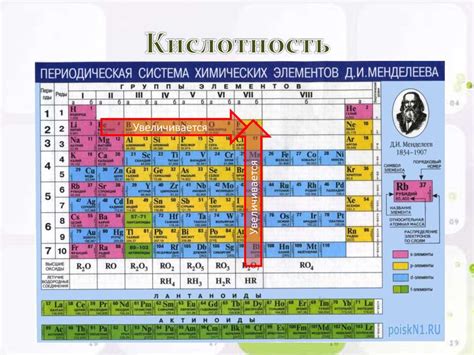
Оксиды металлов представляют собой химические соединения, состоящие из металлического и кислородного атомов. Они обладают рядом особенных свойств, которые могут различаться в зависимости от типа металла и его окислительного состояния.
1. Форма и состояние: Оксиды металлов могут быть представлены в различных физических состояниях, включая газообразные, жидкие и твердые. Например, оксид железа может быть в виде железного (II) оксида (FeO) или железного (III) оксида (Fe2O3), которые являются твердыми кристаллическими веществами.
2. Растворимость: Растворимость оксидов металлов в воде может значительно варьировать. Некоторые оксиды, такие как оксид натрия (Na2O) и оксид калия (K2O), хорошо растворяются в воде и образуют щелочные растворы. В то время как другие оксиды, такие как оксид алюминия (Al2O3) и оксид железа (Fe2O3), практически не растворяются в воде и образуют кислотные растворы.
3. Кислотно-основные свойства: Оксиды металлов классифицируются как щелочные, нейтральные или кислотные в зависимости от их реакции с водой. Щелочные оксиды образуют щелочные растворы, которые проявляют щелочные свойства (например, оксид натрия образует гидроксид натрия). Нейтральные оксиды не проявляют щелочных или кислотных свойств (например, оксид железа). Кислотные оксиды образуют кислотные растворы, которые проявляют кислотные свойства (например, оксид серы образует серную кислоту).
4. Свойства катализаторов: Многие оксиды металлов обладают каталитическими свойствами, то есть они способны ускорять химические реакции без изменения своей структуры. Например, оксид цинка (ZnO) может использоваться в качестве катализатора в горячей селективной окислительной реакции. Катализаторы на основе оксидов металлов широко используются в промышленности для улучшения химических процессов.
Химические особенности оксидов металлов
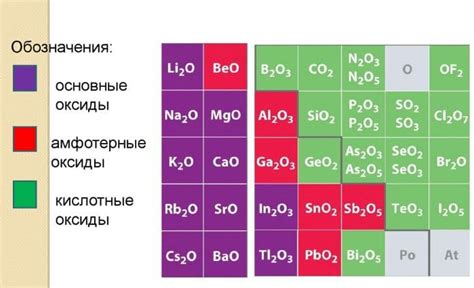
Оксиды металлов - это химические соединения, образованные из металла и кислорода. Они имеют ряд химических особенностей, которые определяют их свойства и применение в различных областях.
Во-первых, оксиды металлов обладают высокой степенью стабильности и инертности. Это делает их хорошими материалами для защиты металлических поверхностей от коррозии. Оксиды металлов образуют защитные слои на поверхности металла, предотвращая его взаимодействие с окружающей средой.
Во-вторых, оксиды металлов обладают каталитической активностью. Они способны ускорять химические реакции, участвуя в них как катализаторы. Благодаря этому свойству оксиды металлов широко применяются в промышленности для производства различных химических веществ и материалов.
Кроме того, оксиды металлов обладают полупроводниковыми свойствами. Это означает, что они могут проводить электрический ток только в определенных условиях. Это свойство делает оксиды металлов полезными для производства электронных устройств, таких как транзисторы и солнечные батареи.
Некоторые оксиды металлов также обладают фотореактивными свойствами, то есть они могут взаимодействовать с светом, вызывая химические реакции. Это свойство используется в фотохимии и фотокатализе.
Таким образом, химические особенности оксидов металлов определяют их значимость в различных областях науки и техники. Изучение этих соединений помогает расширить наши знания о свойствах материалов и разработать новые технологии и применения.
Примеры оксидов металлов
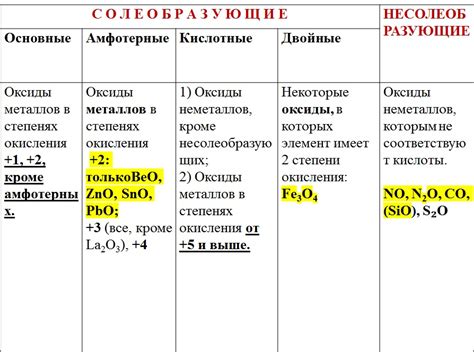
Оксиды металлов представляют собой соединения металла с кислородом. Они обладают различными свойствами и используются в различных сферах деятельности человека.
Одним из наиболее известных оксидов металлов является оксид железа (II) – FeO. Этот оксид имеет черный цвет и применяется в производстве магнитов, ферромагнитных материалов и красок.
Оксид меди (II) – CuO – имеет черный или темно-коричневый цвет. Он используется в производстве стекла и керамических изделий, а также в качестве катализатора в различных химических процессах.
Оксид алюминия – Al2O3 – известен как алюминий. Он применяется в производстве алюминиевых сплавов, керамики и стекла. Кроме того, оксид алюминия используется как катализатор, абразивное вещество и компонент в лаках и красках.
Оксид цинка – ZnO – широко используется в косметике, солнцезащитных средствах и лекарственных препаратах. Он также применяется в электронике, для изготовления полупроводников и в производстве резиновых изделий.
- Примеры оксидов металлов включают:
- оксид железа (II) – FeO
- оксид меди (II) – CuO
- оксид алюминия – Al2O3
- оксид цинка – ZnO
Это лишь некоторые примеры оксидов металлов, их существует много других. Каждый оксид обладает своими уникальными свойствами и применяется в различных областях науки и промышленности.
Роль оксидов металлов в промышленности и природе
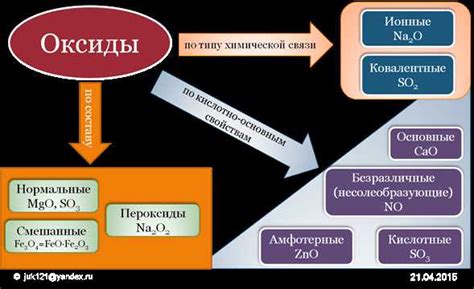
Оксиды металлов играют важную роль и в промышленности, и в природе. Они являются основными соединениями металлов, обладающими различными свойствами, которые находят применение в различных отраслях промышленности.
В процессе производства керамики, оксиды металлов используются как сырье для получения глиняных изделий. Они придают керамике прочность, устойчивость к высоким температурам и химической коррозии. Это позволяет создавать различные изделия, такие как посуда, кафельные плитки и другие строительные материалы.
В производстве стекла также широко используются оксиды металлов, которые придают стеклу определенные свойства. Например, оксид железа оказывает влияние на цвет стекла, оксид свинца повышает прозрачность, а оксид бора делает его устойчивым к высоким температурам.
Оксиды металлов также находят применение в качестве катализаторов в различных химических процессах. Например, оксиды никеля или железа используются в промышленности для получения аммиака или водорода. Оксид цинка активно применяется в производстве каучуков, пластмасс и лакокрасочных материалов.
В природе оксиды металлов также встречаются повсеместно. Например, оксиды железа являются основными компонентами руды железа, которая используется для производства стали. Оксиды алюминия встречаются в виде минерала боксита, который служит сырьем для получения алюминия. Оксиды металлов также входят в состав почв и горных пород.
Таким образом, оксиды металлов играют важную роль и в промышленности, и в природе, обладая различными свойствами и находя применение в различных отраслях человеческой деятельности.
Вопрос-ответ

Какие свойства имеют оксиды металлов?
Оксиды металлов обладают рядом особых свойств. Во-первых, они обычно являются химически активными соединениями, способными взаимодействовать с кислородом, кислотами и другими веществами. Во-вторых, оксиды металлов могут обладать различными степенями окисления металла, что влияет на их химические свойства. Некоторые оксиды металлов обладают кислотными или основными свойствами, в то время как другие являются нейтральными.
Каковы химические особенности оксидов металлов?
Химические особенности оксидов металлов зависят от специфических свойств каждого оксида. Некоторые оксиды металлов обладают высокой степенью растворимости в воде, в то время как другие практически нерастворимы. Некоторые оксиды действуют как кислоты и образуют соли при взаимодействии с основаниями, тогда как другие оксиды могут действовать как основания и образовывать соли при взаимодействии с кислотами. Некоторые оксиды могут также обладать каталитической активностью и быть используемыми в различных химических реакциях.
