Оксиды металлов – это класс химических соединений, которые образуются в результате взаимодействия металлических элементов с кислородом. Они широко распространены в природе и обладают разнообразными свойствами, которые определяются как химическими, так и структурными особенностями каждого конкретного оксида.
Оксиды металлов различаются по своей реакционной активности. Некоторые оксиды, такие как FeO (оксид железа(II)) или Cu2O (оксид меди(I)), обладают полностью ионным характером и легко реагируют с кислородом, дающим более высокоокисленные оксиды. Другие оксиды, например, Al2O3 (оксид алюминия) или SiO2 (оксид кремния), обладают ковалентной структурой и обычно не реагируют с кислородом в обычных условиях.
Оксиды металлов высоко каталитически активны и находят широкое применение в промышленности, включая каталитические процессы, синтез органических соединений и химическую очистку воды и воздуха. Некоторые оксиды металлов, такие, как TiO2 (оксид титана), имеют фотокаталитические свойства и широко используются в солнечных батареях и водоразлагаемых топливных элементах.
Интересным аспектом химических свойств оксидов металлов является их взаимодействие с другими соединениями. Например, оксиды металлов могут реагировать с кислотами, образуя соли. Больше того, некоторые оксиды металлов могут быть растворены в кислотах или щелочах, образуя ионы металлов, которые имеют особые свойства и могут быть использованы в различных химических процессах.
В заключение, оксиды металлов являются важными соединениями с разнообразными химическими и физическими свойствами. Изучение и понимание их химических свойств позволяет создавать новые материалы, разрабатывать новые каталитические процессы и применять их в широком спектре индустриальных и научных областей.
Химические свойства оксидов металлов: ключевые особенности
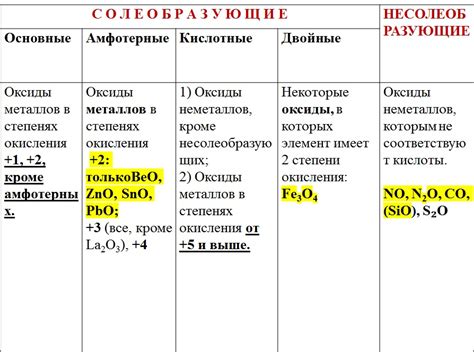
1. Оксиды металлов - это соединения, образующиеся при реакции металлов с кислородом. Они обладают химической формулой МxОy, где М обозначает металл, а x и y - соответствующие их стехиометрические числа.
2. Оксиды металлов могут быть кислотными или основными в зависимости от своего химического характера. Кислотные оксиды образуются от металлов с низкой электронегативностью и кислородом, а основные оксиды - от металлов с высокой электронегативностью и кислородом.
3. Кислотные оксиды металлов обычно растворяются в воде, образуя кислотные растворы. Они могут реагировать с щелочами, образуя соответствующие соли и воду. Например, оксид серы реагирует с водой, образуя серную кислоту:
S + H2O → H2SO4
4. Основные оксиды металлов образуют щелочные растворы при растворении в воде. Они могут реагировать с кислотами, образуя соответствующие соли и воду. Например, оксид кальция реагирует с серной кислотой, образуя сульфат кальция:
CaO + H2SO4 → CaSO4 + H2O
5. Оксиды металлов в основном обладают высокой температурной стабильностью и химической инертностью, что делает их полезными для различных применений. Например, оксид кремния используется в производстве стекла и полупроводников, а оксид алюминия - в производстве керамики и алюминиевых сплавов.
6. Некоторые оксиды металлов обладают фотокаталитической активностью, что позволяет им использоваться в различных процессах, таких как разложение органических веществ и очистка воды от загрязнений.
7. Оксиды металлов также могут образовывать различные полиморфы - разные кристаллические структуры того же соединения. Например, оксид железа может существовать в трех различных полиморфных формах: альфа-Fe2O3, бета-Fe2O3 и гамма-Fe2O3.
В целом, оксиды металлов обладают широким спектром химических свойств и находят применение в различных отраслях промышленности и науки.
Структура оксидов металлов
Оксиды металлов – это химические соединения, образованные из металлического элемента и кислорода. Они обладают разнообразной структурой, которая определяется свойствами металлов и условиями их образования.
Наиболее распространенной структурой оксидов металлов является ионная решетка, где положительные металлические ионы окружены отрицательными кислородными ионами. Другим вариантом структуры оксидов металлов является ковалентная решетка, где атомы металла и кислорода образуют ковалентные связи.
Важным фактором, влияющим на структуру оксидов металлов, является окислительная способность металла. Металлы, обладающие более высокой окислительной способностью, как например, алюминий и магний, имеют оксиды с ионной решеткой. Такие оксиды обычно не растворяются в воде и проявляют сильные щелочные свойства.
Другие металлы, например, железо и медь, имеют оксиды с ковалентной решеткой. Такие оксиды могут образовывать кислотные или амфотерные растворы. Кроме того, некоторые оксиды, например, окись азота, имеют сложную структуру соединения, которая может быть сопоставима с молекулярной структурой.
В итоге, структура оксидов металлов является важным аспектом их химических свойств. Она определяет их растворимость, реакционную способность и влияет на взаимодействие с другими соединениями. Понимание структуры оксидов металлов помогает в изучении их свойств и применении в различных областях промышленности и научных исследований.
Влияние окислительно-восстановительных свойств на оксиды металлов
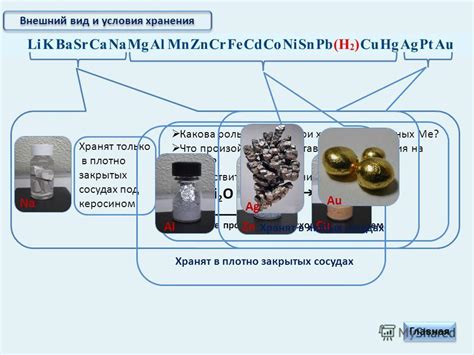
Оксиды металлов обладают различными окислительно-восстановительными свойствами, которые оказывают значительное влияние на их химические реакции и применение в разных областях.
Одним из важных факторов, определяющих окислительно-восстановительные свойства оксидов металлов, является степень окисления металла. Чем выше степень окисления, тем сильнее окислительные свойства у оксида металла. Это связано с возможностью металла отдавать электроны и восстанавливаться после окисления.
Кроме того, окислительно-восстановительные свойства оксидов металлов зависят от их структуры и композиции. Например, присутствие примесей или легирование металла может изменить его окислительные свойства и способствовать активной реакции с другими веществами.
Оксиды металлов могут выступать в роли окислителей или восстановителей в химических реакциях. Например, оксид металла может окислять другой металл, отдавая ему электроны, или восстанавливаться при взаимодействии с веществом, получая электроны от него. Эти свойства позволяют использовать оксиды металлов в разных отраслях промышленности, включая катализ и электрохимию.
Химическая реактивность и стабильность оксидов металлов
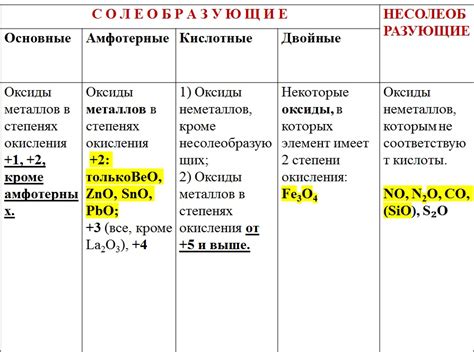
Оксиды металлов проявляют различную химическую реактивность и стабильность в зависимости от своего состава и структуры. Некоторые оксиды металлов, такие как оксиды щелочных и щелочноземельных металлов, являются крайне реактивными веществами, способными активно взаимодействовать с водой и образовывать щелочные растворы.
У некоторых оксидов металлов, в частности переходных металлов, наблюдается большая стабильность и инертность. Такие оксиды образуют защитные слои на поверхности металла и предотвращают его окисление и коррозию. Например, оксид железа (Fe2O3), который является основным компонентом ржавчины, образует защитную пленку на поверхности железа и предотвращает его дальнейшую коррозию.
Некоторые оксиды металлов могут реагировать с другими соединениями и веществами, образуя сложные структуры и соединения. Например, оксид алюминия (Al2O3) может вступать во взаимодействие с кислородом и образовывать силикаты, которые являются основными компонентами глины и керамики.
Степень реактивности и стабильности оксидов металлов также может зависеть от условий окружающей среды, таких как температура, давление и наличие других реагентов. Некоторые оксиды металлов могут быть очень реактивными в одних условиях, но стать более стабильными и инертными при других условиях. Это свойство оксидов металлов широко используется в промышленных процессах и синтезе новых материалов.
Взаимодействие оксидов металлов с кислотами и щелочами

Оксиды металлов могут реагировать с кислотами и щелочами, что приводит к образованию солей и воды. В реакции с кислотами оксиды металлов действуют как основания, а с щелочами - как кислоты.
В результате таких реакций образуется ионная соль, состоящая из катиона металла и аниона кислоты или щелочи. Ионная соль образуется при обмене ионами между оксидом и кислотой или щелочью.
Некоторые оксиды металлов образуют с кислотами растворимые соли, в то время как другие образуют нерастворимые осадки. Это связано с различными степенями ионизации и растворимости данных соединений.
Взаимодействие оксидов металлов с кислотами и щелочами является важным процессом в химической промышленности и сельском хозяйстве. Многие оксиды металлов используются в процессе производства различных солей, а также для коррекции pH в почвах.
В целом, взаимодействие оксидов металлов с кислотами и щелочами - это сложный и многогранный процесс, который требует более детального изучения для полного понимания его механизмов и последствий.
Физические свойства оксидов металлов

Оксиды металлов - это соединения металлов с кислородом. Они имеют разнообразные физические свойства, которые зависят от самого металла и его оксидации.
Первое физическое свойство, которое можно выделить, это цвет оксидов. Они могут быть различных оттенков: красного, желтого, зеленого, черного и даже бесцветного. Например, оксиды железа могут быть красными (Fe2O3), желтыми (Fe2O3·H2O) или черными (Fe3O4).
Еще одно важное физическое свойство - плотность оксидов металлов. Она может варьироваться от очень низкой до очень высокой. Например, оксид алюминия (Al2O3) имеет низкую плотность, а оксид свинца (PbO) - высокую.
Также оксиды металлов обладают различными температурными свойствами. Некоторые оксиды имеют высокую температуру плавления, например, оксид кремния (SiO2) плавится при очень высоких температурах. В то же время, некоторые оксиды плавятся при более низких температурах, например, оксид натрия (Na2O) или оксид кальция (CaO).
Также стоит отметить, что некоторые оксиды имеют магнитные свойства. Например, оксиды железа - Fe2O3 и Fe3O4 обладают ферромагнетическими свойствами, а оксид алюминия (Al2O3) и оксид меди (CuO) - диамагнитными.
В общем, физические свойства оксидов металлов очень разнообразны и зависят от конкретного соединения. Они включают в себя цвет, плотность, температурные и магнитные свойства. Изучение этих свойств дает возможность получить более полное представление о химических соединениях и их применениях в различных сферах науки и техники.
Катализаторы на основе оксидов металлов
Катализаторы на основе оксидов металлов играют важную роль в химической промышленности и научных исследованиях. Они обладают уникальными свойствами, позволяющими ускорять химические реакции и повышать эффективность процессов. Оксиды металлов, такие как оксид железа, оксид меди, оксид цинка и др., являются одними из наиболее часто используемых материалов для создания катализаторов.
Оксиды металлов обладают разнообразными каталитическими свойствами. Например, оксид железа (Fe2O3) может использоваться в реакциях окисления и гидроокисления органических соединений. Оксид меди (CuO) отлично справляется с реакциями дехлорирования, дегидрирования и окисления. Оксид цинка (ZnO) широко применяется в реакциях преобразования углеводородов и синтеза органических соединений.
Важным свойством катализаторов на основе оксидов металлов является их стабильность и долговечность. Они могут быть использованы в условиях высоких температур и давления без потери активности. Благодаря своим физико-химическим свойствам, оксиды металлов обеспечивают стабильность катализаторов и позволяют им эффективно участвовать в реакциях на протяжении длительного времени.
Катализаторы на основе оксидов металлов находят широкое применение в различных отраслях промышленности, таких как производство пластмасс, нефтехимия, фармацевтика и другие. Они играют важную роль в процессах синтеза, очистки и модификации химических соединений. Кроме того, они используются в экологических технологиях для очистки отходов и улавливания вредных веществ.
Использование оксидов металлов в электрохимии
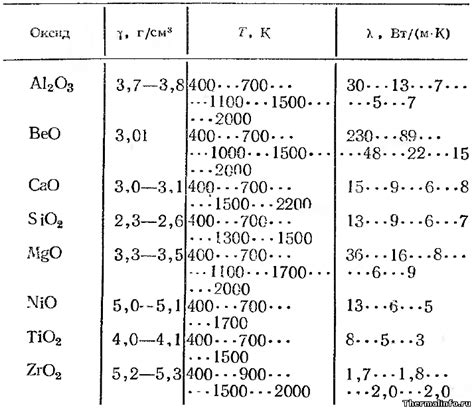
Оксиды металлов широко используются в электрохимических процессах, благодаря своим уникальным химическим свойствам. Эти соединения способны взаимодействовать с различными веществами и электродами, что позволяет использовать их в различных электрохимических реакциях.
Одним из важных применений оксидов металлов в электрохимии является их использование как активных катализаторов. Многие оксиды металлов обладают высокой активностью в катализаторах для различных электрохимических реакций, таких как окисление веществ, восстановление и даже водородная эволюция.
Кроме того, оксиды металлов могут использоваться в электрохимических конденсаторах и аккумуляторах. Некоторые оксиды металлов, такие как оксид марганца, оксид кобальта или оксид никеля, обладают высокой емкостью и способностью сохранять энергию. Благодаря этим свойствам, эти оксиды металлов активно применяются в современных батареях и аккумуляторах.
Также оксиды металлов играют важную роль в процессе электролиза. Например, оксид алюминия используется в электролизе в алюминиевой промышленности для получения металла. При проведении электролиза оксид металла разлагается на металл и кислород, а полученный металл осаждается на катоде.
В целом, использование оксидов металлов в электрохимии позволяет эффективно проводить различные электрохимические процессы, такие как катализ реакций, хранение энергии и процессы электролиза. Уникальные химические свойства оксидов металлов обусловливают их широкое применение в различных областях, связанных с электрохимией.
Важность оксидов металлов в промышленных процессах
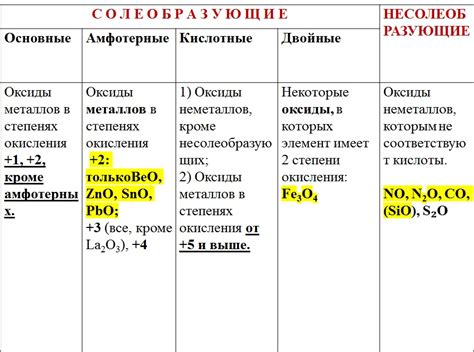
Оксиды металлов имеют особое значение в промышленности, так как они обладают широким спектром полезных свойств и применяются в различных отраслях. Благодаря своим химическим и физическим свойствам, оксиды металлов являются неотъемлемой частью процессов производства различных материалов, соединений и изделий.
Одним из важных применений оксидов металлов является использование их как катализаторов в промышленных процессах. Благодаря своей активности и специфичности реакций, оксиды металлов могут ускорять и совершенствовать процессы синтеза различных веществ. Например, оксид железа используется в производстве аммиака, а оксид меди – в синтезе этилена.
Кроме того, оксиды металлов играют важную роль в области электроники и электротехники. Они используются, например, в производстве полупроводниковых материалов, которые являются основой для создания различных электронных компонентов. Оксиды металлов также применяются в качестве покрытий для металлических поверхностей, обеспечивая им защиту от окисления и коррозии.
Кроме указанных выше областей, оксиды металлов находят применение в процессах производства стекла, керамики, красок, эмалей и других материалов. Они обладают различными свойствами, такими как прозрачность, цветность, стойкость к высоким температурам и агрессивным средам, что делает их незаменимыми компонентами во многих производственных процессах.
Вопрос-ответ

Каковы основные свойства оксидов металлов?
Основные свойства оксидов металлов включают их способность реагировать с водой, образовывая основания, а также реакцию с кислотами, образование солей и горение при высоких температурах. Оксиды металлов также могут обладать кислотными свойствами.
Что происходит при реакции оксидов металлов с водой?
При реакции оксидов металлов с водой образуются основания. Например, реакция между оксидом натрия и водой приводит к образованию гидроксида натрия и выделению тепла. Реакция оксидов металлов с водой может быть экзотермической или эндотермической, в зависимости от специфических условий.
Возможно ли растворение оксидов металлов в кислотах?
Да, оксиды металлов могут растворяться в кислотах. Некоторые оксиды металлов образуют соли, растворяясь в кислотах. Например, оксид меди растворяется в разбавленной серной кислоте, образуя сульфат меди.
Какие еще интересные свойства имеют оксиды металлов?
Оксиды металлов также могут обладать кислотными свойствами. Некоторые оксиды металлов могут растворяться в водах и образовывать кислотные растворы, которые проявляют кислотные свойства. Кроме того, некоторые оксиды металлов имеют фотокаталитические свойства и могут использоваться в процессах, связанных с обработкой загрязненных вод и воздуха.
Какие оксиды металлов используются в промышленности?
В промышленности широко используются различные оксиды металлов. Например, оксид цинка используется в производстве резин и керамических материалов, оксид алюминия - в производстве стекла и керамики, оксид железа - в производстве стали и красителей. Оксиды металлов также используются в производстве электронных компонентов, катализаторов и других продуктов.
