Оксид фосфора является неорганическим соединением, состоящим из атомов фосфора и кислорода. Это один из наиболее распространенных и хорошо изученных оксидов. Необходимо отметить, что оксид фосфора также обладает рядом уникальных химических свойств, особенно при взаимодействии с металлами.
Взаимодействие оксида фосфора с металлами достаточно интенсивно и может протекать через различные химические реакции. При этом, оксид фосфора может оградить металл от воздействия окружающей среды, предотвратить коррозию, а также способствовать формированию структур с новыми свойствами.
Одним из примечательных химических свойств оксида фосфора является его способность образовывать стабильные соединения с металлами, что позволяет использовать их в различных отраслях промышленности. Например, оксид фосфора может быть использован в качестве компонента покрытий для металлов, улучшающих их коррозионную стойкость и износостойкость.
Также стоит отметить, что оксид фосфора обладает некоторыми катализаторными свойствами. Он может принимать активное участие в химических реакциях с металлами, повышая их скорость и эффективность. Такие свойства оксида фосфора находят применение в катализе различных процессов, включая синтез органических соединений и производство пластиков.
Химические свойства оксида фосфора

Оксид фосфора – химическое соединение, состоящее из атомов фосфора и кислорода, обозначается формулой P2O5. Он обладает множеством уникальных химических свойств, обусловленных его структурой и компонентами.
Оксид фосфора является амфотерным соединением, что означает его способность взаимодействовать как с кислотами, так и с щелочами. При реакции с водой оксид фосфора образует фосфорную кислоту, которая обладает выраженной кислотностью и используется в промышленности и науке.
Оксид фосфора также обладает высокими окислительными свойствами. Он может взаимодействовать с множеством металлов, образуя соединения различных степеней окисления. Например, с металлическим натрием оксид фосфора реагирует, образуя натриевый фосфат. Также по этой причине оксид фосфора находит применение в производстве металлургических и химических соединений.
Оксид фосфора является высокотоксичным веществом и требует соблюдения особых мер предосторожности при его использовании или хранении. При контакте с водой оксид фосфора выделяет ядовитые пары фосфорной кислоты, что может привести к отравлению.
Физические свойства оксида фосфора
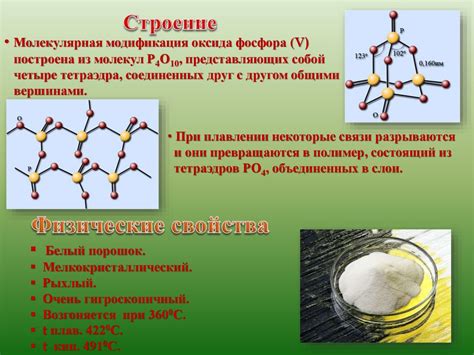
Оксид фосфора, также известный как фосфорный ангидрид, является химическим соединением из группы оксидов. Пусть он не обладает выразительными физическими свойствами, но некоторые из них наиболее заметны и релевантны.
Цвет и внешний вид
Оксид фосфора обычно представляет собой бесцветное или белое кристаллическое вещество в виде порошка или гранул. Это типичное состояние оксида фосфора, но он также может быть представлен в различных физических формах, таких как стекловидные или аморфные структуры.
Температура плавления и кипения
Оксид фосфора обладает сравнительно высокой температурой плавления, равной приблизительно 580 °C (1076 °F). Он не кипит при обычных условиях, поскольку вещество является твердым веществом при комнатной температуре и давлении.
Растворимость
Оксид фосфора плохо растворим в воде и не растворяется в многих органических растворителях. Он может образовывать слабые кислоты при контакте с водой, что делает его амфотерным соединением. Вместе с тем, оксид фосфора может растворяться в кислых растворах и образовывать соединения, такие как фосфорная кислота.
Плотность
Плотность оксида фосфора составляет примерно 2,39 г/см³ при комнатной температуре. Это способствует его использованию в различных областях промышленности и науки, где высокая плотность материала является важным свойством.
Химические реакции оксида фосфора
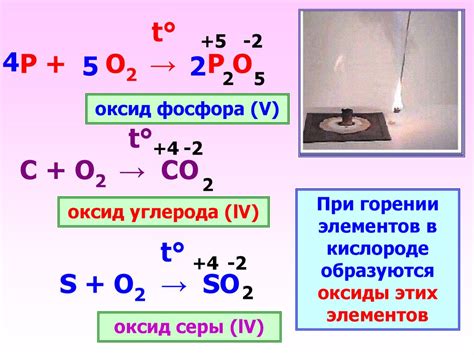
Оксид фосфора, также известный как фосфорный пентоксид (P2O5), обладает высокой химической активностью и может взаимодействовать с различными металлами. В результате этих реакций образуются различные соединения, которые имеют важное промышленное, техническое и научное значение.
Одной из химических реакций оксида фосфора является его реакция с металлическими оксидами. При этом образуется фосфат металла (MPO4), который представляет собой соединение металла с фосфатной группой. Например, при взаимодействии оксида фосфора с оксидом натрия (Na2O) образуется натрийфосфат (Na3PO4).
Оксид фосфора может также реагировать с металлическими галогенами, такими как хлор (Cl2), бром (Br2) или йод (I2). При этом образуются соответствующие фосфорные галогениды – соединения фосфора с галогеном. Например, реакция оксида фосфора с хлором приводит к образованию хлорида фосфора (PCl5).
Оксид фосфора может реагировать и с металлами, образуя соответствующие фосфиды. Фосфиды представляют собой соединения фосфора с металлом, в которых фосфор присутствует в отрицательной степени окисления. Например, оксид фосфора может реагировать с алюминием (Al), образуя алюминиевый фосфид (AlP).
Таким образом, оксид фосфора может взаимодействовать с различными металлами, образуя разнообразные соединения, которые находят применение в различных областях науки и техники.
Сочетание оксида фосфора с металлами

Оксид фосфора – химическое соединение, образующееся при сгорании фосфора. Оксид фосфора может образовывать соединения с различными металлами, что приводит к образованию фосфатов – солей, в которых фосфатные группы являются основными строительными блоками. Сочетание оксида фосфора с металлами обладает рядом интересных химических свойств, обусловленных особенностями взаимодействия между ними.
Соединение оксида фосфора с металлами находит широкое применение в различных областях промышленности. Например, фосфатные соли применяются в производстве удобрений, стекла, керамики, а также в металлургии при получении и обработке металлов. В частности, фосфаты используются для образования пленок на металлических поверхностях, что позволяет предотвратить их коррозию.
Сочетание оксида фосфора с металлами также имеет большое значение в биологических системах. Фосфаты являются неотъемлемой частью аденозинтрифосфата (АТФ), основного источника энергии для клеточных процессов. Также фосфаты входят в состав ДНК и РНК, играя важную роль в передаче и хранении генетической информации.
Оксид фосфора и его соединения с металлами представляют собой важные объекты исследований в области материаловедения и катализа. Разработка новых материалов на основе фосфатов позволяет создавать материалы с новыми свойствами, например, улучшенной электропроводностью или магнитными свойствами. Кроме того, сочетание оксида фосфора с металлами может применяться в качестве катализатора для различных химических реакций, благодаря своей высокой активности и стабильности.
Образование фосфидов металлов

Фосфиды металлов – это соединения, образованные при взаимодействии металлов с оксидом фосфора. Взаимодействие происходит при высоких температурах и сопровождается химической реакцией.
Образование фосфидов металлов может происходить как с простыми, так и с составными металлами. В результате реакции между оксидом фосфора и металлом образуются различные фосфидные соединения.
Примеры образования фосфидов металлов:
- Фосфид кальция (Ca3P2) образуется при нагревании металлического кальция с оксидом фосфора.
- Фосфид железа (FeP) получается путем взаимодействия металла с ортофосфатом натрия (Na3PO4).
- Фосфид алюминия (AlP) синтезируется путем реакции алюминия со вторичным фосфатом натрия (NaHPO4) в атмосфере фосфора.
Образование фосфидов металлов является важным процессом в химической промышленности. Фосфиды металлов активно применяются в различных областях, включая производство сплавов, полупроводниковую промышленность и катализаторы.
Реакции оксида фосфора с металлами
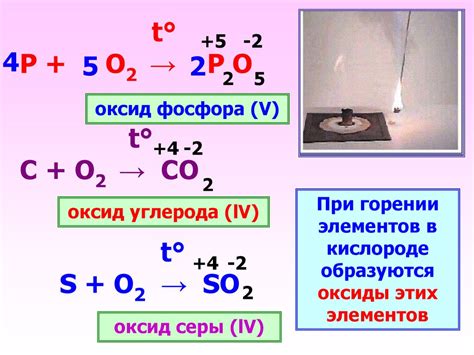
Оксид фосфора, химическое соединение, образуется при сочетании фосфора с кислородом. Он может проявлять различные реакции при контакте с металлами.
Взаимодействие оксида фосфора с щелочными металлами, такими как натрий и калий, приводит к образованию щелочных фосфатов. Эта реакция обусловлена высокой реакционной способностью оксида фосфора и его способностью к кислотному окислению щелочных металлов.
С металлами второй группы (алюминий, цинк, кадмий) оксид фосфора реагирует взрывоопасно и может вызывать автокаталитические разрушения металла при высоких температурах. В результате этой реакции образуется фосфид металла.
Оксид фосфора также может вступать в реакцию с некоторыми тяжелыми металлами, такими как серебро или ртуть. В результате этой реакции образуются соответствующие фосфаты металлов.
Реакция оксида фосфора с металлами может быть сопровождена выделением тепла и газов. Это обусловлено высокой активностью оксида фосфора, который имеет огромное применение в химической промышленности и научных исследованиях.
Вопрос-ответ

Какие свойства оксида фосфора делают его ценным сочетанием с металлами?
Оксид фосфора хорошо растворяется в воде, что делает его удобным для применения в различных химических процессах. К тому же, оксид фосфора обладает высокой температурной стабильностью, что делает его устойчивым к высоким температурам, что является важным свойством при использовании в сочетании с металлами.
В чем основное назначение соединений оксида фосфора с металлами?
Соединения оксида фосфора с металлами применяются в различных областях: от производства удобрений до создания электронных и оптических материалов. За счет своих уникальных свойств, таких как высокая термостабильность и хорошая растворимость в воде, эти соединения находят широкое применение в различных индустриях.
Можно ли использовать оксид фосфора в сочетании с любыми металлами?
Оксид фосфора может быть использован в сочетании с различными металлами, однако выбор металла зависит от конкретной задачи и условий использования. Некоторые металлы могут образовывать более стабильные и реактивные соединения с оксидом фосфора, чем другие. Поэтому важно учитывать химические свойства как оксида фосфора, так и выбранного металла при выборе сочетания.
