Металлы – это класс химических элементов, которые обладают рядом основных химических свойств, делающих их уникальными и важными среди других веществ. В данной статье мы рассмотрим основные химические характеристики металлов, а также выявим их особенности.
Одной из главных характеристик металлов является их способность проводить тепло и электричество. Большинство металлов обладает высокой электропроводностью, что делает их неотъемлемой частью современной техники и электроники. Кроме того, металлы проявляют эффект термопроводности, то есть способность передавать тепло, что делает их идеальными материалами для изготовления теплообменников и конденсаторов.
Еще одной основной характеристикой металлов является их малая электроотрицательность. Благодаря этому свойству, металлы обладают тенденцией к потере электронов при взаимодействии с другими элементами, что способствует их хорошей реакционной активности. В результате, металлы образуют ионы положительного заряда (катионы), которые легко вступают в химические реакции с отрицательно заряженными ионами (анионами) и образуют ионные соединения.
И еще одной важной характеристикой металлов является их способность образовывать сплавы. Сплавы представляют собой смешение двух или более металлов, обладающих новыми свойствами, не характерными для отдельных компонентов. Это свойство металлов позволяет создавать материалы с желаемыми физическими и химическими свойствами для использования в самых разных сферах деятельности.
Таким образом, основные химические свойства металлов, такие как электропроводность, малая электроотрицательность и способность образовывать сплавы, делают их основными и незаменимыми материалами в различных областях науки, технологии и промышленности.
Атомный и ионный радиус металлов
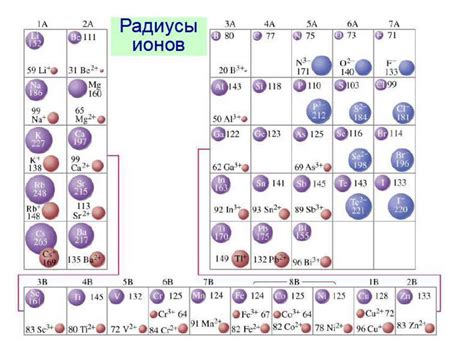
Атомный и ионный радиус являются основными показателями размера атома и иона металла. Они определяются величиной электронной оболочки и взаимодействием атомных ядер с электронами.
Атомный радиус представляет собой половину расстояния между ядрами двух соседних атомов в кристаллической решетке металла. Он зависит от размера атома и определяет его объем. Обычно атомный радиус выражается в пикометрах (1 пикометр = 10^-12 м).
Ионный радиус металла определяется размером его иона, который может быть положительным или отрицательным. Если металл образует ион с положительным зарядом (катион), то его ионный радиус будет меньше атомного радиуса из-за потери одного или нескольких электронов. Если металл образует ион с отрицательным зарядом (анион), то его ионный радиус будет больше атомного радиуса из-за приобретения дополнительных электронов.
Атомный и ионный радиус металлов имеют систематическую зависимость от положения элемента в периодической таблице. Общая тенденция заключается в увеличении атомного и ионного радиусов с увеличением атомного номера и переходом от верхних групп к нижним группам. Ионный радиус также зависит от валентности металла и его химической активности.
Реакция металлов с кислородом

Металлы могут образовывать соединения с кислородом в результате реакции окисления. Данное явление известно как окисление металлов. Окисление металлов обычно сопровождается выделением тепла и образованием оксидов.
Оксиды металлов часто имеют кристаллическую структуру и обладают различными физическими свойствами, такими как цвет, твердость и плотность. Некоторые оксиды металлов имеют высокую степень инертности и могут быть использованы для защиты металлов от коррозии.
Реакция металлов с кислородом может происходить как взаимодействие металла с молекулами кислорода в воздухе, так и с раскаленным кислородом при высоких температурах. Некоторые металлы, такие как натрий и калий, взрываются при контакте с кислородом.
- Натрий реагирует с кислородом, образуя белый порошок натриевого оксида. Реакция идет следующим образом: 4Na + O2 → 2Na2O.
- Железо реагирует с кислородом, образуя ржавчину – смесь оксидов железа. Реакция идет следующим образом: 4Fe + 3O2 → 2Fe2O3.
- Магний реагирует с кислородом, образуя белый порошок оксида магния. Реакция идет следующим образом: 2Mg + O2 → 2MgO.
Некоторые металлы, такие как алюминий и цинк, образуют защитную пленку оксида на своей поверхности, которая предотвращает дальнейшее окисление металла. Это объясняет их устойчивость к коррозии.
Окисление металлов имеет применение в различных областях жизни, таких как производство металлических сплавов, производство красок и лаков, а также в медицине.
Металлы в качестве катализаторов

Металлы широко используются в химических реакциях в качестве катализаторов. Катализаторы – это вещества, которые ускоряют протекание химических реакций, не участвуя при этом в самих реакциях. Они могут увеличить скорость реакции в несколько раз, что позволяет сэкономить время и энергию.
Металлы обладают высокой активностью в реакциях, благодаря своим специфическим электронным свойствам. Они могут adsorbed вещества на своей поверхности, образуя комплексные соединения, которые и играют роль катализаторов. В основном, металлы используются в форме порошков или специально подготовленных поверхностей, чтобы обеспечить максимальную активность и доступность активных центров для реагентов.
Некоторые металлы, такие как платина, палладий и родий, являются очень дорогими и используются только в малых количествах в качестве катализаторов. Однако, современная наука и технологии разрабатывают новые типы катализаторов, которые могут быть более эффективны и дешевые. Например, наночастицы металлов имеют большую поверхность, что увеличивает их активность и позволяет снизить требуемое количество катализатора.
Использование металлов в качестве катализаторов имеет широкое применение в промышленности, особенно в производстве пластмасс, лекарственных препаратов, удобрений и многих других химических продуктов. Катализаторы на основе металлов позволяют снизить затраты на производство и сделать процессы более эффективными и экологически безопасными.
Вопрос-ответ

Какие основные химические свойства металлов?
Основные химические свойства металлов включают высокую теплопроводность, электропроводность, способность образовывать ионы и металлическую структуру. Также металлы хорошо реагируют с кислородом, образуя оксиды, и проявляют активность в реакциях с кислотами.
Какова характеристика металлической структуры металлов?
Металлы имеют кристаллическую структуру, в которой положительно заряженные металлические ионы расположены в решетке и образуют положительные заряженные ионы. Между ионами действуют силы притяжения под воздействием межионного взаимодействия. Благодаря такой структуре, металлы обладают высокой пластичностью и упругостью.
Как происходит реакция металлов с кислотами?
Металлы проявляют активность в реакциях с кислотами. При контакте с кислотой металл образует соль и выделяет водород. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода. Это связано с тем, что металлы обладают высокой электроотрицательностью и способностью отдавать электроны, что позволяет им реагировать с кислотами.
