Металлы - это элементы, обладающие рядом характерных свойств, среди которых особенно важны их химические свойства. Одним из важнейших аспектов химии металлов является их взаимодействие с кислородом, водой и кислотами. Эти процессы играют ключевую роль в различных аспектах нашей жизни: от ржавчины металлических конструкций до использования металлов в различных индустриальных процессах.
Взаимодействие металлов с кислородом - это процесс окисления, который приводит к образованию оксида металла. Некоторые металлы, такие как железо, медь и алюминий, очень восприимчивы к окислению и образованию оксидов при контакте с воздухом или влагой. Например, железо при окислении образует ржавчину (оксид железа), которая может повредить структуру и прочность металлического изделия.
Вода также может оказывать разрушительное воздействие на металлы. Реакция металла с водой может привести к образованию оксидов, гидроксидов или водородных газов. Некоторые металлы, например натрий, очень реактивны и взаимодействуют с водой с выделением водорода и образованием гидроксида металла. Другие металлы, такие как золото и платина, стабильны и не реагируют с водой.
Кислоты также могут взаимодействовать с металлами, образуя соли и выделяя водород. Реактивность металлов с кислотами зависит от их электрохимического потенциала. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя водород. Однако, металлы, такие как золото и платина, устойчивы к действию большинства кислот.
Взаимодействие металлов с кислородом, водой и кислотами - это важная химическая реакция, которая оказывает влияние на различные сферы нашей жизни, начиная от защиты металлических конструкций от коррозии и заканчивая использованием металлов в различных промышленных процессах.
Свойства металлов при взаимодействии с кислородом
Металлы обладают способностью взаимодействовать с кислородом, что является одной из основных причин их окисления. Когда металлы взаимодействуют с кислородом, происходит образование оксидов металлов.
Взаимодействие металлов с кислородом может протекать в различных условиях. Например, при обычной температуре и нормальном давлении, металлы, такие как железо или алюминий, медленно окисляются воздухом, образуя пленку оксида на поверхности. Эта пленка, называемая пассивной, служит защитой от дальнейшего окисления металла.
Однако некоторые металлы взаимодействуют с кислородом более активно. Например, реакция металлов с кислородом может протекать с выделением тепла и света. Такие реакции называются горением. Наиболее ярким примером является горение магния, которое сопровождается ярким огнем и образованием белого порошка - магния оксида.
Взаимодействие металлов с кислородом имеет важное практическое применение. Например, процесс окисления металлов используется при получении оксидов, которые находят широкое применение в различных областях, включая производство керамики, стекла, электродов и других материалов.
Окисление металлов и образование оксидов
Окисление металлов - это химическая реакция, в результате которой металл вступает во взаимодействие с кислородом и образует оксид. Каждый металл имеет свою способность к окислению, которая зависит от его химических свойств.
Металлы активных групп, такие как щелочные и щелочноземельные металлы, активно взаимодействуют с кислородом, окисляются и образуют оксидные соединения. Например, натрий реагирует с кислородом воздуха и образует оксид натрия (Na2O).
Металлы неметалловой группы, такие как алюминий и железо, также подвержены окислению, но их оксиды имеют более сложный состав. Например, алюминий окисляется до оксида алюминия (Al2O3), а железо - до оксида железа (Fe2O3).
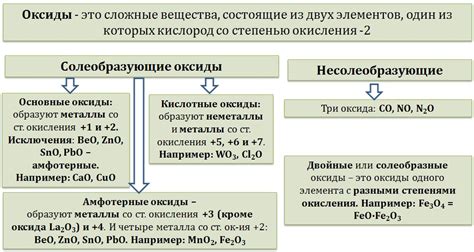
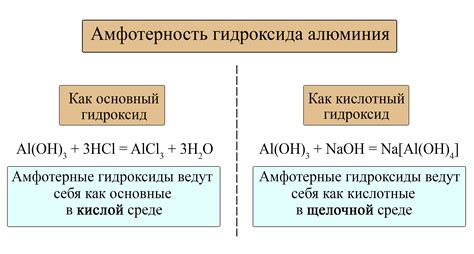
Оксиды металлов имеют различные физические и химические свойства. Некоторые оксиды являются основаниями и образуют гидроксиды в реакции с водой, например, оксид натрия образует гидроксид натрия (NaOH). Другие оксиды склонны к образованию кислот, например, оксид алюминия может реагировать с водой, образуя кислоту алюминия (H2Al2O4).
Устойчивость металлов к окислению

Многие металлы обладают уникальными химическими свойствами, включая их устойчивость к окислению. Окисление является процессом, при котором металл взаимодействует с кислородом воздуха или другими химическими соединениями, что может привести к образованию оксидов и других соединений металла.
Устойчивость металлов к окислению зависит от их атомной структуры и электрохимической активности. Некоторые металлы, такие как золото и платина, являются химически инертными и практически не подвержены окислению в обычных условиях. Они образуют тонкую пленку оксида на поверхности, которая предотвращает дальнейшее окисление.
Другие металлы, такие как железо, алюминий и цинк, обладают более высокой активностью и подвержены окислению. Они образуют более плотные и прочные слои оксида, которые защищают металл от дальнейшего взаимодействия с кислородом. Однако, если эта защитная пленка повреждена или удалена, металл может продолжить окисление.
Устойчивость металлов к окислению может быть изменена при взаимодействии с другими веществами или при изменении условий окружающей среды. Например, некоторые металлы, такие как алюминий и магний, могут быть оксидированы сильными кислотами или щелочами. Кроме того, высокие температуры и влажность также могут способствовать окислению металлов.
Знание устойчивости металлов к окислению является важным для их выбора и использования в различных отраслях промышленности, включая строительство, автомобильную и авиационную промышленность, электронику и многие другие. Металлы с высокой устойчивостью к окислению могут быть использованы в условиях, где требуется длительная стойкость к воздействию кислорода и других окисляющих веществ.
Свойства металлов при взаимодействии с водой
Вода является одним из наиболее распространенных соединений на Земле и имеет важное значение для многих химических процессов. Взаимодействие металлов с водой является одним из таких процессов.
Вода может как коррозировать, так и увлажнять металлы. Во время взаимодействия с водой, некоторые металлы проявляют высокую химическую активность. Например, натрий и калий реагируют со водой с образованием гидроксида металла и выделением водорода.
Другие металлы, такие как алюминий и цинк, могут реагировать с водой только в присутствии веществ, которые способствуют выделению водорода. Кислоты ускоряют реакции металлов с водой, так как они могут доноры протонов и участвуют в образовании ионов металла и гидроксида.
Взаимодействие металлов с водой может приводить к образованию оксидов и гидрооксидов. Например, алюминий образует оксид Al2O3 при реакции с водой, а магний образует гидрооксид Mg(OH)2 при взаимодействии с водой.
Свойства металлов при взаимодействии с водой имеют практическое значение в различных сферах, таких как производство электроэнергии, производство металлических изделий и других областей промышленности.
Образование гидроксидов металлов
Гидроксиды металлов – это химические соединения металлов с гидроксильными группами (OH-). Образование гидроксидов является одним из основных химических свойств металлов и основано на их реакции с водой.
При взаимодействии металлов с водой происходит гидролиз, в результате которого образуются гидроксиды. Этот процесс может быть спонтанным или требовать участия реактивов.
Многие металлы образуют гидроксиды, которые имеют щелочную реакцию. К ним относятся натрий, калий, магний, кальций и алюминий. Гидроксиды этих металлов широко используются в различных отраслях промышленности и быта.
Некоторые металлы образуют нерастворимые или слаборастворимые гидроксиды, такие как оксид железа (III), оксид алюминия и оксид хрома. Они используются в качестве катализаторов, пигментов и других важных добавок в различных технологических процессах.
Реакция металлов с водой в зависимости от их активности

Металлы проявляют различную активность при взаимодействии с водой. Эта активность обусловлена химическими свойствами металлов, их электрохимическим потенциалом и способностью образовывать оксидные пленки на поверхности.
Наиболее активные металлы, такие как натрий, калий и литий, реагируют с водой достаточно интенсивно. При контакте с водой они образуют гидроксиды, а в результате эволюции газа может наблюдаться выделение водорода. Это реакция металлов с водой, которая сопровождается характерными пузырьками водорода.
Менее активные металлы, как цинк и железо, обладают способностью образовывать пленки оксидов на поверхности. Это позволяет им реагировать с водой медленнее и более умеренно. При этом такие металлы могут образовывать гидроксиды с осадком.
Некоторые металлы, например медь и серебро, обладают низкой активностью и почти не реагируют с водой. Они могут образовывать только малое количество гидроксида, наблюдаемого в виде слабой пленки или осадка.
Таким образом, реакция металлов с водой зависит от их активности, которая в свою очередь определяется электрохимическими свойствами металлов. Это явление имеет большое практическое значение и используется в различных отраслях промышленности и научных исследованиях.
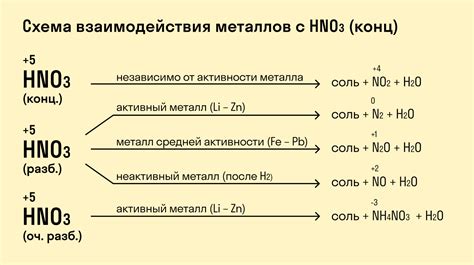
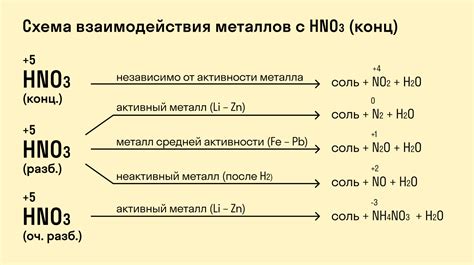
Свойства металлов при взаимодействии с кислотами
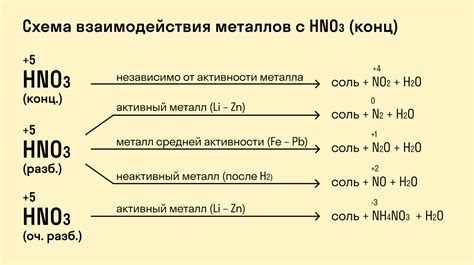
Металлы взаимодействуют с кислотами и проявляют различные химические свойства в зависимости от своей активности. Некоторые металлы, такие как натрий, калий и магний, реагируют сильно с кислотами, выделяя газы и образуя соли.
Активные металлы, такие как алюминий и цинк, реагируют с кислотами, образуя гидриды и соли. При этом выделяется водородный газ, который является характерным признаком реакции. Другие металлы, такие как серебро и золото, не реагируют с кислотами и обладают высокой стойкостью к воздействию кислотных растворов.
Однако, некоторые металлы могут реагировать с кислотами только при нагревании. Например, железо образует растворимые соли с некоторыми кислотами, такими как соляная кислота, при нагревании. Это свойство позволяет использовать железо для растворения некоторых типов ржавчины.
Металлы также могут проявлять свойства при взаимодействии с неорганическими кислотами, такими как серная и азотная кислоты. При этом образуются соли, которые могут быть использованы в различных областях промышленности и науки.
Образование солей и выделение водорода

Химические свойства металлов проявляются во взаимодействии с различными веществами. Под действием кислорода металлы могут образовывать оксиды. Реакция с кислородом протекает с выделением тепла и света. Например, железо при взаимодействии с кислородом образует оксид железа (III):
4Fe + 3O₂ → 2Fe₂O₃
Это примерной уравнения окисления железа воздухом. Многие металлы способны образовывать оксиды, что объясняет их способность к коррозии под воздействием кислорода.
Металлы также могут реагировать с водой и образовывать основания или щелочи. Некоторые металлы реагируют с водой достаточно активно, возникает химическое взаимодействие, при котором образуется водородный газ, а на поверхности образуется щелочной раствор. Например, натрий реагирует с водой следующим образом:
2Na + 2H₂O → 2NaOH + H₂
Металлы также могут реагировать с кислотами и образовывать соли. При этом выделяется водородный газ. Например, цинк реагирует с соляной кислотой:
Zn + 2HCl → ZnCl₂ + H₂
Такой механизм взаимодействия металлов с кислотами называется общекатионной реакцией. В результате этого процесса образуется соль и выделяется водородный газ.
Реакция различных групп металлов с кислотами

Металлы могут реагировать с кислотами, образуя соли и выделяя водород. Реакция металлов с кислотами зависит от их электрохимических свойств и позиции в ряду активности.
1. Алкалийные металлы (например, литий, натрий, калий) легко реагируют с кислотами, образуя соли и выделяя водород. Эта реакция сопровождается обильным выделением пузырей газа.
2. Щелочноземельные металлы (например, магний, кальций, барий) также могут реагировать с кислотами, но их реакция протекает более спокойно по сравнению с алкалийными металлами. Выделяющийся газ при этой реакции также является водородом.
3. Переходные металлы (например, железо, медь, никель) не реагируют с кислотами при обычных условиях, так как они не обладают достаточной активностью. Однако некоторые переходные металлы могут реагировать с сильными оксидирующими кислотами.
4. Постпереходные и благородные металлы (например, цинк, алюминий, свинец, серебро, золото) обычно не реагируют с кислотами. Это связано с тем, что они обладают высокой устойчивостью к окислению и образованию солей.
5. Ряд активности металлов позволяет предсказать возможность реакции с кислотами. Металлы внизу ряда активности более активны и реагируют с большим количеством кислот, чем металлы вверху ряда.
- Активные металлы реагируют с гидрохлорной (соляной) кислотой, серной кислотой и другими сильными кислотами.
- Более инертные металлы не реагируют с сильными кислотами и могут реагировать лишь с некоторыми слабыми кислотами.
Таким образом, реакция различных групп металлов с кислотами зависит от их электрохимических свойств и позиции в ряду активности, что важно учитывать при изучении химических свойств металлов.
Вопрос-ответ

Что происходит при взаимодействии металлов с кислородом?
При взаимодействии металлов с кислородом образуется оксид металла.
Какие металлы реагируют с водой?
Некоторые металлы, такие как натрий, калий и кальций, реагируют с водой, выделяя водород и образуя гидроксид металла.
Какие кислоты могут реагировать с металлами?
Металлы могут реагировать с различными кислотами, такими как соляная кислота, серная кислота и азотная кислота, образуя соли и выделяя водород.
Почему некоторые металлы реагируют с кислородом быстрее, чем другие?
Скорость реакции металлов с кислородом зависит от их химических свойств и электрохимического потенциала. Металлы с более низким электрохимическим потенциалом реагируют быстрее.
