Химические свойства металлов представляют собой особенности их взаимодействия с другими веществами. Изучение химических свойств металлов является важной частью программы по химии в 9 классе. В учебнике Габриеляна рассматриваются основные понятия и примеры, позволяющие понять и описать различные явления и реакции, связанные с металлами.
Одним из основных понятий, рассматриваемых в учебнике, является химическая активность металлов. Активность металлов определяется их способностью вступать в химические реакции. Более активные металлы легко реагируют с веществами в окружающей среде, образуя соединения. Например, натрий и калий активно реагируют с водой, при этом выделяется водород. Более низкая активность имеют металлы, такие как серебро и золото, которые практически не реагируют с водой и воздухом.
Другим важным понятием является реакция металлов с кислотами. Реакция металлов с кислотами протекает с образованием солей и выделением водорода. В учебнике приведены примеры реакций металлов с различными кислотами, такими как соляная кислота, серная кислота и азотная кислота.
Например, реакция цинка с серной кислотой приводит к образованию сульфата цинка и выделению газообразного водорода: Zn + H2SO4 → ZnSO4 + H2.
Изучение химических свойств металлов позволяет понять и объяснить множество явлений, происходящих вокруг нас, а также найти практическое применение металлов в различных отраслях промышленности и научных исследованиях. Учебник Габриеляна представляет ученикам полную и понятную информацию о химических свойствах металлов с множеством примеров, что способствует лучшему освоению материала и развитию химического мышления.
Металлы и их химические свойства

Металлы – это класс веществ, которые обладают определенными химическими свойствами. Одним из основных химических свойств металлов является их способность образовывать ионы положительного заряда.
Металлы легко отдают свои электроны, что позволяет им образовывать ионы положительного заряда – катионы. Благодаря этому свойству металлы обладают высокой электропроводностью и теплопроводностью.
Еще одно химическое свойство металлов – их способность реагировать с различными веществами и образовывать соединения. Металлы могут реагировать с кислотами, щелочами, кислотными оксидами и другими веществами, образуя соли и гидроксиды.
Однако не все металлы одинаково активны в химических реакциях. В таблице активности металлов можно найти информацию о том, какой металл активнее или менее активен по сравнению с другими металлами. Активность металлов зависит от их положения в ряду активностей.
Изучение химических свойств металлов позволяет понять, как они реагируют с другими веществами и какие соединения они образуют. Это важно для понимания и применения металлов в различных областях науки и техники, таких как металлургия, электротехника и катализ.
Строение и свойства металлической решетки
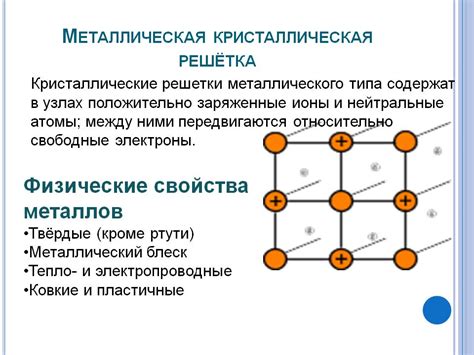
Металлическая решетка представляет собой кристаллическую структуру, образованную атомами металла, которые образуют регулярную трехмерную сетку. Эти атомы прикреплены друг к другу посредством атомных связей, которые обладают высокой прочностью и способностью к перемещению.
Структура металлической решетки характеризуется наличием металлической связи, которая обуславливает такие свойства металлов, как высокая пластичность, теплопроводность и электропроводность. Металлы обладают большой скоростью диффузии атомов, что им позволяет эффективно проводить тепло и электричество.
Одной из особенностей металлической решетки является наличие свободных электронов, образующих "электронное облако" вокруг атомов. Эти свободные электроны являются ответственными за электропроводность металлов и способность металлов отражать свет.
Свойства металлической решетки также определяются кристаллической структурой металла. Например, в двухкомпонентных сплавах атомы разных металлов могут занимать точечные позиции в решетке, что способствует образованию интерметаллических фаз и изменению свойств сплава.
В целом, строение и свойства металлической решетки обуславливают широкий спектр применений металлов в различных отраслях промышленности, а также делают их важными материалами для разработки новых технологий.
Активность металлов и их реакции с кислотами
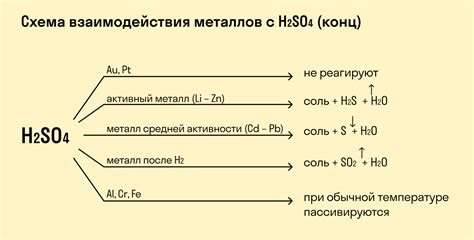
Активность металлов - это их способность образовывать соединения с другими веществами, в том числе с кислотами. Она зависит от положения металла в ряду активности металлов, который составляется в порядке убывания их активности. Чем выше в ряду находится металл, тем активнее он будет взаимодействовать с кислотами.
Металлы могут реагировать с различными кислотами, например с соляной кислотой, серной кислотой или солянками. Реакция металла с кислотой приводит к образованию солей и выделению водорода. При этом металлы могут иметь разную активность, поэтому реакция может проходить с различной интенсивностью.
Наиболее активные металлы, такие как калий и натрий, реагируют с кислотами очень быстро и интенсивно. При этом выделяется большое количество водорода, а раствор кислоты становится мутным из-за образования солей.
Менее активные металлы, такие как магний или цинк, реагируют с кислотами менее интенсивно. Реакция происходит медленнее, и выделяется меньше водорода. Однако, эти металлы все равно способны образовывать соли с кислотами.
Наиболее низкой активностью обладают металлы, такие как медь и свинец. Они реагируют с кислотами очень слабо или практически не реагируют вообще. Поэтому для их реакции требуется повышенная температура или другие условия.
Свойства металлов при взаимодействии с кислородом
Металлы обладают рядом особых свойств при взаимодействии с кислородом. В результате окисления многие металлы образуют оксиды. Оксиды металлов часто можно встретить в природе в виде минералов и руд. Известно большое количество оксидов, например, оксид железа (Fe2O3), оксид алюминия (Al2O3) и др.
Оксиды металлов обладают различными свойствами. Некоторые из них являются кислотными, другие – основными, а еще другие – амфотерными. Кислотные оксиды растворяются в воде, образуя кислоты, например, оксид серы (SO2) образует серную кислоту (H2SO4). Основные оксиды образуют лишь гидроксиды и растворяются в воде с образованием щелочей, например, оксид натрия (Na2O) образует гидроксид натрия (NaOH).
Кроме оксидов, металлы могут образовывать пероксиды, гидрооксиды и другие соединения при взаимодействии с кислородом. Пероксиды – это оксиды с повышенным содержанием кислорода, например, пероксид водорода (H2O2). Гидрооксиды (гидроксиды) – это соединения металлов с гидроксильной группой (OH), например, гидроксид натрия (NaOH).
Металлы в реакциях с неметаллами

Металлы проявляют активность в реакциях с неметаллами, что обусловлено их способностью отдавать электроны и образовывать ионные связи.
Взаимодействие металлов с кислородом приводит к образованию металлических оксидов. Например, в реакции железа с кислородом образуется железный оксид (Fe2O3). При этом железо отдает свои электроны, а кислород их принимает.
Металлы также могут реагировать с галогенами, образуя соли галогенидов металлов. Например, натрий реагирует с хлором, образуя хлорид натрия (NaCl). В таких реакциях металл отдает свои электроны, а галоген их принимает.
Еще одной реакцией металлов с неметаллами является образование солей кислородных кислот. Например, медь реагирует с серной кислотой, образуя сульфат меди (CuSO4). В этой реакции металл отдает электроны, а неметалл их принимает.
Иногда в реакциях металлов с неметаллами образуются не только ионные связи, но и ковалентные. Например, в водородной реакции натрий реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водород. В этом случае образование связей с участием электронов происходит более равномерно.
Примеры химических реакций металлов в учебнике Габриеляна

Учебник Габриеляна представляет примеры различных химических реакций металлов, которые помогают учащимся лучше понять и запомнить особенности поведения различных металлов.
Один из таких примеров - распад медного карбоната. При нагревании медного карбоната он разлагается на медный оксид и углекислый газ. Эта реакция иллюстрирует способность металлов образовывать оксиды при взаимодействии с кислородом.
Еще один пример - реакция цинка с серной кислотой. При взаимодействии цинка с серной кислотой образуются цинксульфат и водород. Этот пример демонстрирует способность металлов вступать в реакцию с кислотами и образовывать соли.
Также в учебнике Габриеляна приводятся примеры окислительно-восстановительных реакций с участием металлов. Например, реакция алюминия с медным (II) оксидом, в результате которой алюминий окисляется, а медный (II) оксид восстанавливается до меди.
На основе этих и других примеров учащиеся могут узнать о различных химических свойствах металлов и их способности вступать в реакции с различными веществами.
Вопрос-ответ

Какие химические свойства металлов можно выделить в 9 классе?
В 9 классе выделяются такие химические свойства металлов, как активность, способность образовывать ионы и соли, способность растворяться в кислотах и реагировать с ними, способность образовывать оксиды и с кислородом образовывать основные оксиды.
Какие примеры можно привести для объяснения химических свойств металлов в 9 классе?
Примеры химических свойств металлов в 9 классе могут быть, например, реакция меди с серной кислотой, образование оксида железа(III) при взаимодействии железа с кислородом, реакция натрия с хлором, образование ионов магния и хлора при растворении хлорида магния в воде и другие.
