Металлы – одна из основных групп веществ, которая имеет ряд характерных химических свойств. В данном конспекте урока мы рассмотрим основные химические свойства металлов и их значимость в нашей жизни.
Металлы обладают высокой химической активностью и способностью образовывать соединения с другими элементами. Однако, не все металлы взаимодействуют с одинаковой интенсивностью. Некоторые металлы, такие как натрий и калий, очень реактивны и активно взаимодействуют с водой и кислородом. Другие металлы, такие как золото и платина, являются химически инертными и практически не взаимодействуют с другими веществами.
Одним из важнейших свойств металлов является их способность проводить электрический ток. Это свойство обусловлено особенностями строения атомов металлов и образования электронов проводимости. Благодаря этому свойству, металлы широко используются в производстве электроники, электропроводки и других областях, где требуется перенос электрического тока.
Кроме того, металлы обладают высокой теплопроводностью и прочностью, что делает их незаменимыми в производстве строительных материалов, автомобилей, самолетов и многих других изделий.
Также, металлы являются хорошими катализаторами, т.е. веществами, ускоряющими химические реакции, не вступая самими в реакцию. Именно благодаря этому свойству многие металлы нашли применение в производстве химических соединений, медицине и других отраслях.
Таким образом, химические свойства металлов играют важную роль в нашей жизни, определяя их широкое применение в различных областях науки и промышленности. Понимание этих свойств позволяет нам более глубоко изучить мир веществ и использовать их потенциал для достижения наших целей и потребностей.
Химические свойства металлов

Металлы обладают уникальными химическими свойствами, которые делают их важными и неотъемлемыми частями нашей жизни. Химические свойства металлов включают их реактивность, способность к окислению и восстановлению, а также их способность образовывать различные соединения.
Металлы обычно имеют высокую реактивность и легко вступают в химические реакции. Они часто реагируют с кислородом из воздуха, образуя оксиды металлов. Некоторые металлы, такие как натрий и калий, являются настолько реактивными, что они реагируют с водой, выделяя гидроген и образуя гидроксиды металлов.
Металлы также способны к окислению и восстановлению. Окисление - это процесс, при котором металл связывается с кислородом и образует оксид металла, а восстановление - это процесс обратный окислению, при котором металл возвращает потерянные им электроны.
Металлы также способны образовывать различные соединения с другими элементами. Они могут образовывать ионы, соли и комплексные соединения, которые широко используются в различных отраслях промышленности, как например, производство лекарств, красителей, покрытий и многое другое.
В целом, химические свойства металлов делают их незаменимыми материалами в нашей жизни. Они играют важную роль в нашей повседневной жизни и в различных технологиях, способствуя прогрессу и развитию нашего мира.
Классификация, свойства, применение

Металлы можно классифицировать по разным признакам. Одним из основных признаков является отношение к щелочным, щелочноземельным и переходным металлам. Щелочные металлы являются наиболее активными. К ним относятся литий, натрий, калий и др. Они обладают высокой реактивностью и используются, например, в производстве щелочных батарей. Щелочноземельные металлы, такие как магний, кальций, стронций, имеют меньшую активность и широко используются в металлургии.
Металлы обладают рядом свойств, которые делают их особенно полезными в различных сферах. Одно из основных свойств - высокая теплопроводность. Именно благодаря этому свойству металлы активно используются в производстве теплопроводящих материалов, например, в технике охлаждения электронных компонентов.
Одним из наиболее важных свойств металлов является их электропроводность. Благодаря этому свойству металлы широко применяются в производстве электроники и электротехники. Они являются основными материалами для проводников электрического тока.
Металлы также обладают высокой пластичностью и прочностью. Это позволяет использовать их в машиностроении, авиации, строительстве и других отраслях для создания различных конструкций и деталей, которые должны быть прочными и долговечными.
Применение металлов в нашей жизни очень широко. Они используются в производстве автомобилей, самолетов, кораблей, строительных конструкций, бытовой техники и многих других областях. Также металлы широко применяются в медицине, например, для изготовления имплантатов и медицинских инструментов.
Химические реакции и взаимодействие с другими веществами
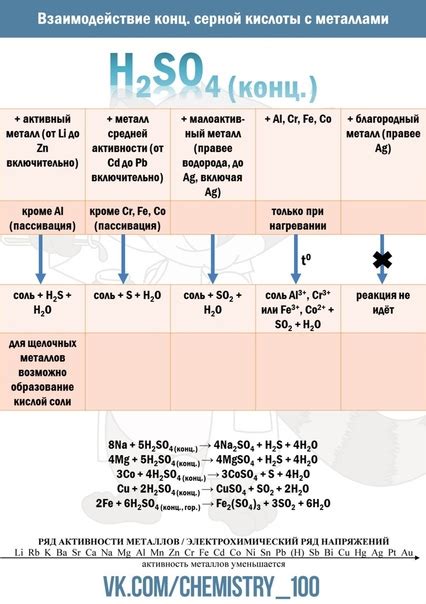
Металлы обладают высокой химической реакционной способностью и активностью в химических реакциях. Они способны вступать во взаимодействие с различными веществами, проявляя свои уникальные химические свойства.
Одна из основных химических реакций, которая происходит с металлами, - это окисление, то есть взаимодействие с кислородом. Металлы могут связываться с кислородом при нагревании или в результате контакта со взрывчатыми веществами. В результате металлы образуют оксиды, такие как оксид железа или оксид алюминия, которые имеют свои химические и физические свойства.
Еще одной химической реакцией, в которую металлы могут вступать, является образование солей. При взаимодействии с кислотами, металлы могут образовывать соли, которые имеют характерные химические формулы и могут применяться в различных отраслях промышленности.
Также металлы могут вступать в реакцию с водой или паром воды, образуя гидроксиды. Некоторые металлы, такие как натрий или калий, реагируют очень активно с водой, выделяя водород и образуя щелочи. Это реакция, которая может протекать достаточно быстро и с выделением большого количества тепла.
Металлы могут также реагировать с другими веществами, например, с кислотами, щелочами или солями. Такие реакции могут протекать с образованием побочных продуктов в виде солей или газов, таких как водород или углекислый газ. Эти реакции часто применяются в химической промышленности для получения различных соединений и материалов.
Электрохимия и гальванические элементы

Электрохимия – раздел химии, изучающий явления, связанные с превращением химической энергии в электрическую и наоборот.
Гальванический элемент – это устройство, в котором происходит превращение химической энергии реакций в электрическую энергию.
Гальванические элементы состоят из двух полумоментов, изначально нейтральных по отношению друг к другу, и соединены проводником. Один из полумоментов содержит окислительное вещество, а другой – восстановительное вещество. Между полумоментами существует разность потенциалов, что приводит к потоку электронов по проводнику.
Наиболее распространенным гальваническим элементом является простейший гальванический элемент, состоящий из двух электродов и электролита. Электроды могут быть выполнены из разных материалов и образуют пару анод-катод.
Основными элементами гальванического элемента являются электроды, на поверхности которых протекают окислительно-восстановительные реакции. Электроды погружены в электролит, при этом на поверхности электродов образуются заряженные ионами.
По принципу работы гальванические элементы делятся на простейшие и составные. В простейших элементах параметры их работы определяются только свойствами материалов, из которых изготовлены электроды и состоят электролиты. Составные гальванические элементы состоят из нескольких простейших элементов, соединенных последовательно или параллельно.
Окислительно-восстановительные реакции
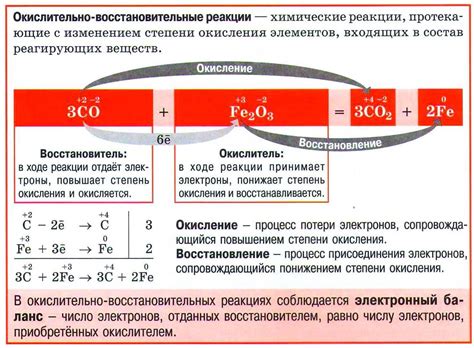
Окислительно-восстановительные реакции – это химические реакции, при которых происходит перенос электронов от одного вещества к другому. В таких реакциях одно вещество окисляется, т.е. отдает электроны, а другое вещество восстанавливается, т.е. принимает электроны.
Металлы, входящие в активный ряд, обладают высокой активностью и легко окисляются, образуя положительно заряженные ионы – катионы. В окислительно-восстановительных реакциях они выступают в роли веществ, отдающих электроны и окисляющихся. Металлы могут взаимодействовать с разными веществами, например, с кислородом, кислотами, солями и другими соединениями.
Окислительные реакции металлов проявляются в их способности соединяться с кислородом воздуха. В таких реакциях металл совершает передачу электронов кислороду и окисляется. Примером такой реакции может служить горение магния в воздухе:
- Mg + O2 –> MgO
В результате реакции магний окисляется, а кислород восстанавливается, формируя оксид магния.
Восстановительные реакции металлов проявляются в их способности отдавать электроны и вступать во взаимодействие с положительно заряженными ионами, такими как ионы металлов или водорода. Например, металл натрий может взаимодействовать с ионами водорода воды:
- 2Na + 2H2O –> 2NaOH + H2
В результате реакции натрий окисляется, а ионы водорода восстанавливаются, образуя гидроксид натрия и молекулы водорода.
Такие окислительно-восстановительные реакции металлов широко используются в промышленности и повседневной жизни для получения различных продуктов и энергии.
Вопрос-ответ

Какие свойства металлов можно отнести к химическим?
К химическим свойствам металлов относятся их реакция с кислотами и щелочами, окисление (взаимодействие с кислородом), образование окислов и гидридов, а также реактивность металлов в растворах их солей.
Что происходит при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами образуется соль и выделяется водород. Уравнение реакции зависит от вида металла и кислоты. Например, при реакции цинка с соляной кислотой образуется хлорид цинка и выделяется водород: Zn + 2HCl = ZnCl2 + H2.
Какие металлы активно реагируют с кислородом?
Некоторые металлы, такие как натрий, калий и магний, активно реагируют с кислородом воздуха, образуя оксиды. Например, натрий при взаимодействии с кислородом образует оксид натрия: 4Na + O2 = 2Na2O.
Как образуются окислы металлов?
Окислы металлов образуются при взаимодействии металлов с кислородом. Наиболее распространенные окислы металлов - оксиды. Например, оксид железа (III) образуется при взаимодействии железа с кислородом: 4Fe + 3O2 = 2Fe2O3.
Что такое гидриды металлов?
Гидриды металлов - это соединения, в которых металл связан с водородом. Они образуются при взаимодействии металлов с водородом. Некоторые гидриды металлов являются веществами с повышенной химической активностью. Например, гидрид алюминия (алюминиевый гидрид) можно использовать в качестве мощного восстановителя в органической химии.
