Металлы - это химические элементы, которые обладают определенными свойствами, такими как электропроводность, блеск, способность образовывать соли и сплавы. Их химические свойства полностью определяются реакцией с другими веществами. Реакции металлов могут быть представлены в виде уравнений, которые описывают их взаимодействие с кислотами, водой, кислородом и другими веществами.
Одной из наиболее распространенных реакций металлов является их взаимодействие с кислородом, что приводит к образованию оксидов. Например, реакция железа с кислородом приводит к образованию оксида железа:
4Fe + 3O2 → 2Fe2O3
Также, металлы могут реагировать с водой, что может приводить как к пассивации, так и к образованию гидроксидов. Например, реакция магния с водой может быть представлена следующим уравнением:
Mg + 2H2O → Mg(OH)2 + H2
Кроме того, металлы могут реагировать с кислотами, образуя соответствующие соли и выделяя водород. Например, реакция цинка с соляной кислотой может быть описана следующим уравнением:
Zn + 2HCl → ZnCl2 + H2
Таким образом, уравнения реакций металлов являются важным инструментом для описания и анализа их химических свойств. Эти уравнения позволяют прогнозировать результаты реакций и изучать влияние различных условий на их протекание.
Реакция металлов с кислородом

Кислород является одним из самых распространенных элементов в земной коре и составляет около 46% ее массы. Он также играет важную роль в химических реакциях с металлами. Взаимодействие металлов с кислородом приводит к образованию оксидов металлов.
Реакция металлов с кислородом характеризуется высокой активностью кислорода, который стремится проникнуть в структуру металла, окислив его. В результате такой реакции образуется соединение металла с кислородом - оксид. Оксиды металлов могут иметь различные свойства, например, оксид цинка обладает свойствами полупроводников, а оксид железа может иметь как ферромагнитные, так и ферроэлектрические свойства.
Реакции металлов с кислородом могут быть представлены следующими уравнениями:
- Медь + кислород -> оксид меди (цинковый тип):
- 2Cu + O2 -> 2CuO
- Магний + кислород -> оксид магния (цинковый тип):
- 2Mg + O2 -> 2MgO
- Железо + кислород -> оксид железа (цинковый тип):
- 4Fe + 3O2 -> 2Fe2O3
Реакция металлов с кислородом важна для понимания процессов коррозии металлов, так как воздействие кислорода может привести к образованию окисных пленок на поверхности металла, которые защищают от дальнейшего окисления.
Кроме реакций с кислородом, металлы могут реагировать и с другими элементами и соединениями, что открывает широкие возможности для использования металлов в различных областях, таких как промышленность, медицина, электроника и др.
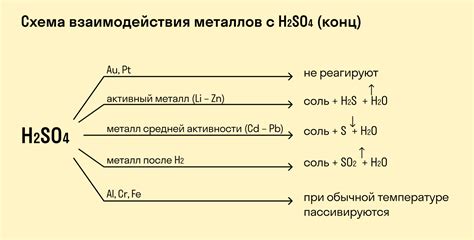
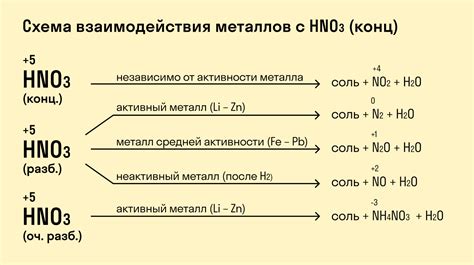
Реакция металлов с кислотами

Металлы обладают способностью реагировать с кислотами, образуя соли и выделяя водород. Это реакция окисления металлов и восстановления кислоты. Реакция также сопровождается выделением тепла.
Металлы, которые находятся выше в электрохимическом ряду, активнее реагируют с кислотами. Они способны реагировать с кислотами даже при комнатной температуре. Например, натрий, калий и магний быстро реагируют с соляной кислотой, образуя хлорид натрия, хлорид калия и хлорид магния соответственно.
Реакция металлов с кислотами может быть представлена уравнением: металл + кислота → соль + водород. Например, цинк реагирует с серной кислотой по следующему уравнению: Zn + H2SO4 → ZnSO4 + H2.
С некоторыми кислотами металлы взаимодействуют более активно. Например, алюминий реагирует с соляной кислотой более интенсивно по сравнению с железом. При этом образуется алюминий хлорид и выделяется водород: Al + HCl → AlCl3 + H2.
Существуют также сильные окислители, такие как концентрированная азотная кислота и концентрированная серная кислота, которые могут реагировать с некоторыми металлами, такими как медь и железо, с выделением дыма и образованием сложных соединений.
Таким образом, реакция металлов с кислотами представляет собой важный процесс, который широко используется в химической промышленности и имеет множество практических применений.
Реакция металлов с щелочами

Металлы могут реагировать с щелочами, образуя соли и выделяяся водород. Реакция происходит вследствие диспропорционирования ионов металла в растворе щелочи.
Реакция металлов с щелочами обычно протекает по типу:
- Металл + вода ⟶ гидроксид металла + водород
- 2 металла + вода ⟶ гидроксид одного металла + гидроксид другого металла + водород.
Например, реакция натрия с водой выглядит следующим образом:
- 2 Na + 2 H₂O ⟶ 2 NaOH + H₂
При реакции металла с щелочью образуется гидроксид металла и обычно наблюдается выделение водорода. Весьма характерной особенностью таких реакций является эволюция пузырей водорода и появление щелочи в растворе. Обычно реакция протекает очень быстро и сильно выделяет тепло.
Кроме натрия, реакцию с щелочью совершают другие металлы, например, калий, литий, рубидий и цезий. Эти элементы также обладают достаточно высокой активностью и проявляются при реакциях с щелочами.
Важно отметить, что некоторые металлы, такие как магний и алюминий, не реагируют с щелочами. Они обладают высокой степенью устойчивости к реакциям с водой и гидроксидами щелочных металлов.
Реакция металлов с солями

Металлы обладают различными свойствами, включая их способность реагировать с солями. Реакция металлов с солями может быть описана с помощью химических уравнений.
Когда металл вступает в реакцию с солью, происходит замещение катиона металла в соли. Металл вытесняет катион из раствора соли и образует новую соль, в которой металл замещает другой металл. Например, если реагентом является медь, а солью — серебро нитрат, то происходит реакция, в результате которой медь вытесняет серебро из соли и образует нитрат меди.
В зависимости от активности металла и его положения в ряду активности металлов, реакция с солями может проходить с различной интенсивностью. Некоторые металлы, такие как группа щелочных металлов и алюминий, очень реакционны и могут вытеснить большинство металлов из солей. Другие металлы, такие как серебро и золото, намного менее реакционны и обладают большей устойчивостью к вытеснению.
Реакция металлов с солями имеет множество применений в различных областях, включая промышленность и химическую лабораторию. Эта реакция широко используется для получения металлов из их солей, а также для получения солей металлов. Благодаря реакции металлов с солями возможно получение различных соединений, которые находят применение в различных областях науки и техники.
Реакция металлов с неорганическими соединениями
Металлы, обладая высокой реакционной способностью, способны взаимодействовать с различными неорганическими соединениями. Эти реакции часто протекают с образованием новых веществ и сопровождаются выделением энергии. Результатом данных реакций могут быть окисление металла, образование солей или же выделение газов.
Одним из наиболее распространенных типов реакций металлов является реакция с кислотами. Металлы активных групп периодической системы таблиц (например, щелочные металлы и металлы первой группы) способны реагировать с кислотами, образуя соли и выделяя водород. Например, реакция металла натрия с соляной кислотой приводит к образованию соли хлорида натрия и выделению водорода.
Металлы также могут реагировать с основаниями, образуя соли и выделяя воду. Например, реакция алюминия с гидроксидом натрия приводит к образованию соли алюминия и выделению воды.
Реакции металлов с неметаллами также не являются редкостью. Многие металлы способны взаимодействовать с галогенами, образуя соли. Например, реакция натрия с хлором приводит к образованию хлорида натрия.
Для уравнения реакций металлов с неорганическими соединениями необходимо учитывать их химические свойства и энергию активации, которая определяет степень реакционной способности металла. Такие реакции являются основой для понимания многих процессов в химической промышленности и естественных науках.
Реакция металлов с органическими соединениями
Металлы являются активными химическими элементами, способными взаимодействовать с различными веществами, включая органические соединения. Реакции металлов с органическими соединениями могут протекать различными способами и приводить к образованию новых веществ и изменениям в структуре органических молекул.
Одной из наиболее известных реакций металлов с органическими соединениями является окислительная реакция. Она заключается в том, что металл окисляет органическое соединение, в результате чего образуются новые химические связи и образцы. Например, при взаимодействии железа с кислородом происходит образование оксида железа, а при окислении спирта медью возникает ацетальдегид.
Кроме окислительных реакций, металлы также могут участвовать в реакциях с органическими соединениями, называемыми редукционными. В этих реакция металл улавливает электроны из молекулы органического соединения и вступает в химическую связь с другими атомами или ионами. Например, при реакции натрия с хлоральгидратом образуется натриевая соль и алкоголь.
Еще одной интересной реакцией металлов с органическими соединениями является метатезная реакция. Эта реакция заключается в обмене ионами или группами атомов между металлом и органическим соединением. Например, при взаимодействии металла цинка соединениями органического вещества формируются соединения цинка, в результате чего происходит перестройка определенных химических связей и образование новых веществ.
Реакция металлов с оксидами

Металлы, как известно, обладают активностью в химических реакциях. Они могут вступать во взаимодействие с различными веществами, в том числе с оксидами. Реакция металлов с оксидами является одной из основных реакций, в результате которой образуется соединение металла с кислородом.
Во время реакции металл может выделяться из своего соединения с оксидом, а кислород – соединяться с металлом. Например, реакция алюминия с оксидом железа проводится следующим образом:
- Сначала нагревается алюминий (Al), который выделяется из своих соединений;
- Затем постепенно добавляется оксид железа (Fe2O3);
- В результате реакции образуется алюминиевый оксид (Al2O3) и железо (Fe).
Реакция металлов с оксидами может протекать с различной интенсивностью в зависимости от активности металла и степени окисления. Некоторые металлы, такие как натрий и калий, реагируют с оксидами даже при небольшом нагревании, в то время как более пассивные металлы, например, алюминий и цинк, требуют значительно более высоких температур для начала реакции.
Помимо этого, реакция металлов с оксидами может протекать не только с образованием соединений, но и с выделением газов. Например, реакция цинка (Zn) с оксидом серы (SO2) приводит к образованию оксида цинка (ZnO) и выделению диоксида серы (SO2) в виде газа.
Реакция металлов с водой

Многие металлы могут взаимодействовать с водой, образуя различные химические соединения. Эти реакции зависят от активности металла и условий проведения эксперимента.
Активные металлы, такие как натрий (Na) и калий (K), реагируют с водой с выделением водорода (H2) и образованием гидроксида металла. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O -> 2NaOH + H2
Менее активные металлы, например, железо (Fe) или алюминий (Al), также могут реагировать с водой, но скорость этих реакций намного медленнее. При взаимодействии железа с водой, образуется оксид железа(III) и выделяется водород:
2Fe + 3H2O -> Fe2O3 + 3H2
Реакция алюминия с водой протекает медленно и требует наличия щелочной среды или катализатора для активации:
2Al + 6H2O + 2NaOH -> 2Na[Al(OH)4] + 3H2
Очень редкие металлы, такие как золото (Au) или платина (Pt), практически не реагируют с водой и обладают высокой устойчивостью.
В результате реакции металлов с водой, выделяющегося водорода можно наблюдать посредством возгорания газа или образования пузырьков на поверхности металла. Также при проведении экспериментов можно использовать реактивные металлы для получения гидрогена.
Вопрос-ответ

Какие химические свойства обладают металлы?
Металлы обладают рядом химических свойств, таких как способность образовывать оксиды и гидроксиды, вступать в реакции с кислотами, образовывать соли и т.д.
Какие уравнения реакций могут быть для металлов?
Уравнения реакций для металлов могут быть различными. Например, металл может вступать в реакцию с кислородом и образовывать оксид, или с водой и образовывать гидроксид и водород. Также металлы могут реагировать с кислотами и образовывать соли.
Какая роль играют химические свойства металлов?
Химические свойства металлов играют важную роль в различных процессах и приложениях. Например, металлы используются в производстве различных материалов, в процессах электролиза, в реакциях окисления и восстановления и т.д.
