Химические свойства металлов являются одной из важных тем при подготовке к экзамену по химии Единого государственного экзамена (ЕГЭ). Знание основных химических свойств металлов позволяет понять и объяснить множество процессов, происходящих в химических реакциях. Знание данных свойств металлов необходимо не только для решения задач экзамена, но и для понимания основных принципов химии в целом.
Ключевым химическим свойством металлов является способность образовывать ионы положительного заряда. Металлы способны отдавать электроны другим веществам и образовывать ионы с положительным зарядом, которые применяются в реакциях образования солей. Это явление называется окислительно-восстановительным свойством металлов.
Большинство металлов проявляет активность в реакциях с водой, кислотами и щелочами. Некоторые металлы, такие как натрий, калий и кальций, реагируют достаточно интенсивно с водой, образуя гидроксид и высвобождая водород. Другие металлы, например, алюминий и цинк, реагируют с кислотами, образуя соли и высвобождая водород. Таким образом, знание реакций металлов с водой, кислотами и щелочами является важным для понимания и предсказания возможных химических процессов.
Важно помнить, что некоторые металлы могут реагировать с кислородом воздуха, образуя оксиды или оксиды и гидроксиды. Это явление называется окислением. Некоторые металлы, такие как железо и алюминий, имеют высокую степень активности и активно окисляются воздухом. Окисление металлов является одним из примеров проявления их химических свойств и может быть использовано для определения активности их реакций.
Основное свойство металлов - способность проводить электрический ток. Это свойство особенно важно для металлов, применяемых в производстве электрических проводов и элементов электроники. Металлы обладают высокой электропроводностью благодаря свободным электронам в их структуре. Свободные электроны движутся по металлу, создавая электрический ток. Это свойство металлов играет важную роль в нашей повседневной жизни и в промышленности.
Основные понятия химических свойств металлов
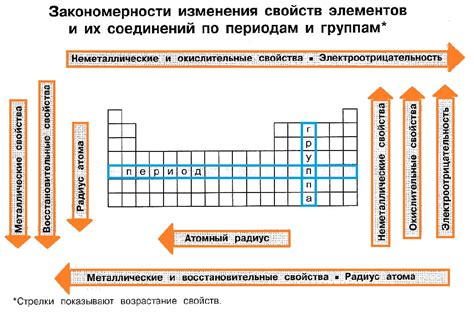
Металлы являются одной из основных групп химических элементов, которые обладают рядом характерных свойств. Основной химической особенностью металлов является их способность образовывать положительные ионы (катионы), отдавая электроны в процессе химических реакций.
Металлы хорошо проводят электричество и тепло. Это связано с их способностью образовывать электронную оболочку, которая легко движется и переносит заряды. Также металлы обладают высокой пластичностью и деформируемостью, что позволяет им быть использованными в различных областях промышленности.
Химические свойства металлов также проявляются в их способности образовывать соли. Металлы образуют ионы, которые связываются с анионами и образуют кристаллическую решетку солей. Эти соли могут быть использованы в различных целях, например, в медицине или в производстве.
Не все металлы обладают одинаковыми химическими свойствами. Например, щелочные металлы, такие как натрий и калий, имеют очень высокую реакционную способность и быстро реагируют с водой или кислородом. При этом, некоторые металлы, например, золото или платина, практически не взаимодействуют с другими веществами и имеют высокую коррозионную стойкость.
Металлы и их химические свойства

Металлы являются одной из основных групп химических элементов, характеризующихся рядом специфических свойств. Они отличаются высокой теплопроводностью и электропроводностью, а также обладают блеском поверхности. Кроме того, металлы обычно образуют положительные ионы, представляющие собой катионы, благодаря своей способности отдавать электроны.
Одним из важных химических свойств металлов является их реакционная способность. Металлы активно вступают во множество химических реакций, в том числе с кислотами и щелочами. Реакции особенно ярко проявляются взаимодействие металлов с кислородом. Большинство металлов окисляется при взаимодействии с воздухом, образуя оксиды или гидроксиды.
Металлы также обладают способностью образовывать сплавы. Сплавы – это материалы, состоящие из двух или более металлических элементов. Образование сплавов позволяет улучшить механические свойства металлов, такие как прочность и твердость. Сплавы используются в различных отраслях промышленности, например, в авиации или машиностроении.
Еще одним важным свойством металлов является их способность к электрохимическим реакциям. Металлы используются как электроды в различных электрохимических процессах, например, в электролизе. Кроме того, металлы часто используются в производстве элементов электроники, таких как провода, контакты и электроды.
Реакции металлов с кислотами и щелочами

Реакции металлов с кислотами
Реакции металлов с кислотами являются одним из важных химических свойств металлов. В зависимости от свойств металла и кислоты, могут происходить различные типы реакций, такие как образование солей и выделение водорода.
Когда металл вступает в реакцию с кислотой, происходит окислительно-восстановительная реакция, сопровождающаяся образованием солей. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению молекулярного водорода.
Реакции металлов с щелочами
Реакции металлов с щелочами также являются важным свойством металлов. В результате этих реакций образуются гидроксиды металлов и выделяется водород. Например, реакция натрия с гидроксидом натрия приводит к образованию гидроксида натрия и выделению молекулярного водорода.
Реакции металлов с щелочами происходят по принципу замещения водорода металлом. Металл активнее водорода, поэтому он вытесняет его из молекулы щелочи и образует соль и водород.
В зависимости от активности металла и концентрации щелочи, скорость реакции может различаться. Активные металлы, такие как натрий и калий, реагируют с водой, образуя гидроксиды и выделяя водород, с большей интенсивностью, чем менее активные металлы.
Коррозия металлов и способы ее предотвращения

Коррозия металлов представляет собой процесс разрушения металла в результате его химической реакции с окружающей средой. Она является значительной проблемой, так как может привести к уменьшению прочности и долговечности металлических конструкций.
Одним из основных способов предотвращения коррозии является использование покрытий защитного слоя на поверхности металла. Они могут быть органическими или неорганическими, их задача заключается в создании барьера между металлом и окружающей средой. Например, гальваническое оцинкование позволяет нанести на поверхность железа тонкий слой цинка, который защищает металл от окисления.
Другим методом предотвращения коррозии является анодная и катодная защита. Эти методы основаны на принципе электрохимической защиты, при которой один металл становится анодом и жертвуется, а другой становится катодом и не подвергается коррозии. Например, при использовании цинкового анода в системе с железное трубопроводом, цинк будет корродироваться вместо железа, предотвращая коррозию последнего.
Еще одним методом предотвращения коррозии является использование антикоррозийных добавок. Они могут быть добавлены в металлические сплавы или покрытия, чтобы они стали более устойчивыми к коррозии. Например, добавление хрома в сталь позволяет создать пассивную оксидную пленку, которая защищает металл от окисления.
В целом, предотвращение коррозии металлов является важной задачей, которая требует применения различных методов и технологий. Совместное использование покрытий, электрохимической защиты и антикоррозийных добавок может значительно увеличить срок службы металлических изделий и сооружений. Это особенно важно с учетом их широкого применения в различных сферах промышленности и строительства.
Металлы и их окислители

Металлы представляют собой группу химических элементов, обладающих характерными физическими и химическими свойствами. Одним из важных аспектов их химии является взаимодействие с окислителями. Окислители – это вещества, которые могут отнимать электроны у других веществ, в том числе у металлов.
Взаимодействие металлов с окислителями происходит по реакциям окисления. При этом металлы способны отдавать электроны и образовывать ионы положительного заряда – катионы. Окислители, наоборот, принимают электроны и образуют анионы отрицательного заряда. Таким образом, металлы и окислители в реакции окисления образуют ионные соединения.
Металлы могут реагировать с различными окислителями. Например, активные металлы, такие как щелочные металлы и щелочноземельные металлы, легко реагируют с водой или кислородом. В результате таких реакций образуются соответствующие ионные соединения и выделяется энергия.
Важно отметить, что реакция окисления металлов может протекать не только с окислителями из внешней среды, но и с самими металлами. Например, при контакте различных металлов между собой может происходить реакция передачи электронов, в результате которой один металл окисляется, а другой восстанавливается. Это основа для создания гальванических элементов и аккумуляторов.
Взаимодействие металлов с неметаллами

Металлы и неметаллы, обладая различными химическими свойствами, взаимодействуют в разных реакциях. Одной из таких реакций является окислительно-восстановительная реакция. В таких реакциях металлы, обладающие более низким окислительным потенциалом, восстанавливают ион неметалла, который обладает более высоким окислительным потенциалом.
Взаимодействие металлов с неметаллами можно проиллюстрировать на примере реакции цинка с серной кислотой. При этом образуются сульфат цинка и водород. Уравнение реакции можно записать следующим образом: Zn + H2SO4 → ZnSO4 + H2. В данном случае цинк действует как восстановитель, а серная кислота – как окислитель.
Взаимодействие металлов с неметаллами обычно сопровождается сильным выделением энергии в виде тепла и света. Это связано с тем, что в ходе реакции происходит высвобождение энергии, которая была запасена в химических связях. Также взаимодействие металлов с неметаллами может сопровождаться изменением цвета вещества или образованием новых фаз.
Взаимодействие металлов с неметаллами имеет широкое применение в промышленности. Например, такая реакция применяется в химической промышленности для получения различных продуктов и сырья. Также можно отметить, что взаимодействие металлов с неметаллами играет важную роль в жизни человека, так как на основе этих реакций строятся различные электрохимические системы, такие как батареи и аккумуляторы, которые широко применяются в нашей повседневной жизни.
Металлы в реакциях с водой и паром

Металлы проявляют свои химические свойства при взаимодействии с различными веществами. В частности, реакция металлов с водой и паром является одной из наиболее известных и изученных.
Многие металлы проявляют активность в реакции с водой, образуя гидроксиды и выделяяся водород. Например, натрий, калий и кальций активно реагируют с водой, образуя гидроксид и выделяя водородный газ. При этой реакции возникает характерное плавание металла на поверхности воды и выделение газовых пузырей.
Однако не все металлы обладают активностью в реакции с водой. Некоторые металлы, такие как железо или цинк, не реагируют с холодной водой. Однако при нагревании с паром они могут вступить в реакцию и образовать соответствующие гидроксиды.
Реакция металлов с паром, также как и реакция с водой, сопровождается выделением водорода. Однако при реакции с паром образуется гидроксид металла и вода в виде пара, в отличие от реакции с холодной водой, где образуется растворимый гидроксид и водородный газ.
Реакции металлов с водой и паром широко используются в различных областях, например, в водородной энергетике, где водородный газ, образующийся при реакции металлов с водой, используется в качестве источника энергии. Также эти реакции могут применяться для получения гидроксидов металлов, которые используются в химической промышленности.
Электрохимические свойства металлов
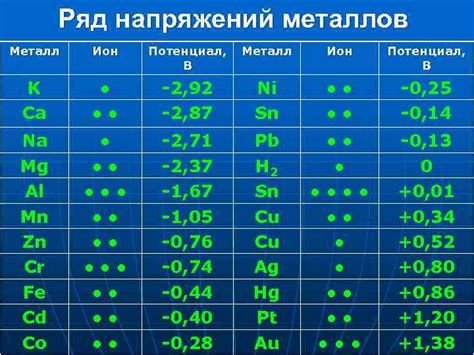
Металл является хорошим проводником электричества, и его электрохимические свойства напрямую связаны с этой способностью. При взаимодействии с растворами электролитов металлы могут проявлять различные электрохимические реакции, такие как окисление, восстановление и растворение.
Окисление металла - это процесс, при котором металл отдает электроны и переходит в состояние положительного иона. Это явление наблюдается, когда металлным предметам подвергаются воздействию кислород или другие окислители. Например, железо подвергается окислению при взаимодействии с кислородом воздуха, образуя ржавчину.
Восстановление металла - это противоположный процесс, при котором положительные ионы восстанавливаются до атомов металла путем получения электронов. Это происходит, например, при использовании металла в электролизе или при взаимодействии с раствором соли на растворимом электроде.
Растворение металла - это процесс, при котором атомы металла переходят в раствор в виде положительных ионов. Некоторые металлы, такие как цинк или магний, могут растворяться при взаимодействии с кислотами, образуя соответствующие соли и выделяя водородный газ.
Электрохимические свойства металлов легко объяснить, основываясь на их положении в ряду электродного потенциала (ряд напряжений). Положение металла в этом ряду позволяет предсказать его способность окисляться или восстанавливаться. Эта информация особенно важна для анализа электрохимических реакций, таких как гальванические элементы или электролиз.
Использование металлов в промышленности и повседневной жизни

Металлы являются неотъемлемой частью промышленности и повседневной жизни человека. Они обладают рядом уникальных свойств, которые делают их необходимыми для различных целей.
В промышленности металлы применяются во множестве областей, включая строительство, производство автомобилей, электронику, аэрокосмическую промышленность и многие другие. Например, железо и сталь широко используются для строительства зданий, мостов и инфраструктуры. Алюминий применяется в производстве автомобилей, самолетов и упаковочных материалов благодаря своей легкости и прочности.
Металлы также неотъемлемы в повседневной жизни. Железо, например, используется для изготовления посуды, инструментов и мебели. Алюминиевые изделия можно найти во многих предметах, таких как кухонная утварь, консервные банки и напиточные банки. Олово используется в производстве ароматизаторов и покрытий на различных поверхностях.
Важно отметить, что металлы имеют высокую электропроводность, что делает их идеальными для использования в проводах и электрических устройствах. Они также обладают термической и химической стойкостью, что позволяет им использоваться в высокотемпературных процессах и агрессивных средах, таких как промышленные печи и химические реакторы.
Итак, металлы играют важную роль в промышленности и повседневной жизни человека. Их уникальные свойства делают их незаменимыми для различных целей, от строительства и производства до создания различных изделий, электроники и устройств.
Вопрос-ответ

Какие элементы обычно относят к металлам?
К металлам обычно относят элементы, которые находятся слева от чередующейся диагонали в периодической системе элементов. Это включает такие элементы, как железо, алюминий, медь, свинец, цинк и многие другие.
Что такое коррозия металлов?
Коррозия металлов - это процесс ухудшения и разрушения металлов под воздействием окружающей среды. При коррозии металлы окисляются и образуются нестабильные соединения, которые могут привести к потере прочности и эстетическому повреждению металлических изделий.
В чем заключается реакция металлов с кислотами?
Реакция металлов с кислотами заключается в образовании солей и выделении водорода. Металлы замещают водород из кислоты, что приводит к образованию солей металлов и водорода. Например, реакция железа с соляной кислотой приводит к образованию хлорида железа и выделению водорода.
Какие металлы имеют самую низкую плотность?
Самую низкую плотность имеют литий, натрий и калий. Они относятся к щелочным металлам и имеют очень малую плотность, что делает их легкими и подходящими для использования в различных приложениях, таких как легкие конструкции или батареи.
