Металлы - это класс веществ, обладающих особыми химическими свойствами. Они обычно достаточно твердые, хорошо проводят электрическую и тепловую энергию, и обладают блеском. Металлы способны образовывать ионы, что является причиной их металлических свойств.
Одно из основных химических свойств металлов - это их реакция с кислородом. Большинство металлов, встречающихся в природе, активно взаимодействуют с кислородом, образуя оксиды. Некоторые металлы даже горят на воздухе, например, магний и алюминий. При этом образуются соответствующие оксиды металлов.
Еще одно важное химическое свойство металлов - это их способность взаимодействовать с кислотами. Металлы представляются в колонке 1-3 таблицы Менделеева. Первые две колонки состоят из щелочных и щелочноземельных металлов, которые активно реагируют с водой и образуют щелочи.
Таблица химических свойств металлов в 8 классе химии
Ниже представлена таблица, в которой указаны основные химические свойства металлов: название, атомный номер, символ, химический тип, плотность, температура плавления и кипения, а также наиболее характерные реакции.
Химические свойства металлов

Металлы - это группа химических элементов, которые обладают рядом характерных свойств. Одно из основных химических свойств металлов - их способность образовывать ион положительного заряда. Это происходит при потере электронов во внешней оболочке атома, что делает металлы по своей природе ионами положительного заряда.
Большинство металлов хорошо проводят электричество и тепло. Это связано с наличием свободных электронов в их кристаллической решетке, которые легко перемещаются и тем самым обеспечивают хорошую электропроводность и теплопроводность.
Кроме того, металлы обладают высокой пластичностью и податливостью. Они могут быть легко прокатаны в листы или вытянуты в проволоку без дополнительного нагрева. Это связано с их кристаллической структурой и способностью атомов металла с легкостью сдвигаться друг относительно друга.
Металлы также активно взаимодействуют с кислородом из воздуха, образуя оксиды. Некоторые металлы могут реагировать с кислотами, образуя соли. Это поведение объясняется тем, что металлы имеют свободные электроны, которые могут быть легко переданы другим атомам или молекулам.
Свойства металлов могут существенно различаться в зависимости от их примесей или сплавов. Например, введение в сплав другого металла может изменить его механические или химические свойства. Это делает металлы весьма универсальными материалами, которые широко используются в различных отраслях промышленности.
Металлы в химии

Металлы являются одной из основных групп элементов в химии. Они обладают рядом особенных свойств, которые отличают их от других элементов, таких как неметаллы.
Основное химическое свойство металлов - способность образования ионов положительного заряда (катионов). Это связано с тем, что металлы изначально имеют отдельные электроны, которые легко отдают. В результате, металлы образуют ионы, у которых внешний электронный уровень полностью заполнен.
Кроме того, металлы хорошо проводят тепло и электричество. Это объясняется тем, что в кристаллической решетке металла отсутствует преграда для движения электронов. Поэтому, электроны свободно перемещаются от одного атома металла к другому, создавая электрический ток.
Металлы также обладают высокой пластичностью и прочностью. Они могут легко деформироваться без разрушения и выдерживать большие нагрузки. Это связано с их особым строением и связями между атомами.
В таблице химических свойств металлов выделены основные характеристики каждого элемента, такие как атомный номер, название, относительная атомная масса и т.д. Такая таблица помогает систематизировать информацию о металлах и легко сравнивать их свойства.
Металлы и их свойства

Металлы - это класс элементов, обладающих такими свойствами, как высокая теплопроводность, электропроводность, пластичность и блеск. Они имеют металлическую структуру, состоящую из кристаллических зерен, межатомных связей и свободных электронов.
Одним из основных свойств металлов является их способность проводить тепло и электричество. Это объясняется наличием свободных электронов, которые могут свободно двигаться по кристаллической решетке металла, перенося с собой тепло и электрический заряд.
Металлы также обладают высокой пластичностью, то есть способностью деформироваться без разрушения. Их кристаллическая структура позволяет атомам смещаться и скользить друг относительно друга при механической нагрузке. Именно благодаря этому свойству металлы могут быть прокатаны, вытянуты и отлиты в различные формы.
Блеск металлов обусловлен наличием свободных электронов, которые могут поглощать и испускать световые волны. Именно поэтому металлы имеют характерный металлический блеск. Однако некоторые металлы из-за окисления могут терять блеск и покрываться толстым слоем оксидов.
Таблица химических свойств металлов поможет нам лучше понять и классифицировать различные металлы по их химическим свойствам. В таблице указаны такие характеристики, как электроотрицательность, активность, способность образовывать ионы, основные окислительные свойства и другие химические свойства металлов.
Как формируются химические свойства металлов
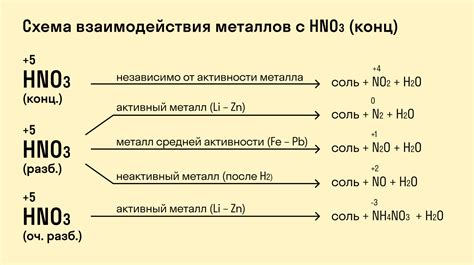
Химические свойства металлов определяются их атомной структурой и особенностями взаимодействия с другими веществами. Основными химическими свойствами металлов являются их способность к окислению, образованию солей, проводимости электричества и тепла.
Атомы металлов имеют радиально-сферическую структуру, что делает их хорошими проводниками электричества. Электроны в металлах свободно перемещаются между атомами, что обуславливает их высокую электрическую проводимость.
Окисление металлов происходит при реакции с кислородом, при котором образуются металлические оксиды. Окисленные металлы могут реагировать с водой, кислотами и щелочами, образуя соответствующие соли. Это связано с высокой активностью металлов и их склонностью отдавать электроны в реакциях взаимодействия с другими веществами.
У металлов также есть способность проводить тепло. Благодаря свободно перемещающимся электронам, металлы могут эффективно передавать тепло от одной частица к другой. Их хорошие теплопроводные свойства делают металлы востребованными материалами для изготовления различных теплопроводящих устройств и конструкций.
Таким образом, химические свойства металлов формируются благодаря их особенной атомной структуре, способности к окислению, образованию солей, проводимости электричества и тепла. Эти свойства делают металлы важными и необходимыми компонентами во многих отраслях промышленности и научных исследований.
Реакции металлов с кислородом

Кислород – это очень активный элемент, который образует соединения с большинством металлов. Реакция металлов с кислородом называется окислительной реакцией.
Некоторые металлы, такие как натрий, калий, кальций, горят при контакте с кислородом. При этом происходит реакция горения, при которой металл соединяется с кислородом и образуется оксид металла. Такой процесс можно наблюдать, например, при сжигании натрия в пробирке под слоем жидкого азота.
Другие металлы, такие как железо, реагируют с кислородом при нагреве, но не горят. Результатом такой реакции является образование оксида металла или гидроксида металла, в зависимости от условий реакции.
Оксиды металлов, полученные в результате реакции с кислородом, могут иметь различные свойства. Они могут быть кислотными, щелочными или амфотерными, в зависимости от металла и условий реакции. Например, оксид кальция (известный как известь) обладает щелочными свойствами и используется в строительстве и производстве химических веществ.
Таблица химических свойств металлов может помочь лучше понять, какие именно металлы реагируют с кислородом и какие соединения образуются в результате реакции.
Реакции металлов с кислотами

Металлы проявляют различную химическую активность при взаимодействии с кислотами. Взаимодействие металлов с кислотами проводится с целью получения солей и выделения водорода.
Самыми активными металлами являются алкали металлы: литий, натрий, калий. Они реагируют с обычными кислотами, такими как соляная кислота (HCl) или серная кислота (H2SO4), с выделением водорода. Реакция протекает следующим образом: металл + кислота → соль + водород.
Некоторые металлы, такие как железо или цинк, также реагируют с кислотами, но только с некоторыми, более концентрированными. Например, железо реагирует с соляной кислотой концентрацией 9% или более, образуя хлорид железа и выделяя водород.
Но не все металлы реагируют с кислотами. Аллюминий, медь или серебро, например, не реагируют с большинством кислот. Они могут быть нейтральными или пассивными по отношению к кислотам.
Таким образом, реакции металлов с кислотами позволяют изучить химическую активность металлов и получить соли и водород.
Реакции металлов с водой

Металлы обладают различными химическими свойствами, включая их реакции с водой. В зависимости от активности металлов, они могут проявлять различные реакции при контакте с водой.
Активные металлы, такие как натрий (Na), калий (K) и литий (Li), реагируют с водой с выделением газа водорода (H2). Эти реакции являются достаточно сильными и могут протекать даже при контакте с холодной водой. Например, натрий и вода реагируют по следующему уравнению: 2Na + 2H2O → 2NaOH + H2.
Более реактивные металлы, такие как магний (Mg) и алюминий (Al), также могут реагировать с водой, но только с горячей водой или с паром. При этом также выделяется водород. Например, реакция алюминия с водой может быть описана следующим уравнением: 2Al + 3H2O → Al2O3 + 3H2.
Однако не все металлы реагируют с водой. Некоторые металлы, такие как железо (Fe) и цинк (Zn), не реагируют с обычной водой. Они требуют наличия кислотных условий для своей реакции. Например, железо может реагировать с кислотой соляной (HCl), выделяя газ водород и образуя растворимую соль: Fe + 2HCl → FeCl2 + H2.
Таким образом, реакции металлов с водой могут быть различными, и их характер зависит не только от активности металла, но и от условий реакции, таких как температура и наличие кислоты.
Реакции металлов с щелочами

Металлы могут активно реагировать с щелочами, образуя соли и выделяя водород. Такие реакции называют щелочными реакциями металлов и они часто используются в лабораторных и промышленных целях.
Щелочные реакции металлов хорошо иллюстрируют их электрохимические свойства. При взаимодействии с щелочью металл передает свои электроны и окисляется, а щелочь восстанавливается, принимая эти электроны. В результате образуется соль и выделяется водородный газ.
Реакционная способность металлов с щелочами зависит от их электрохимической активности. Наиболее активные металлы, такие как натрий и калий, реагируют с водой воздуха, выделяя водород и образуя щелочные растворы соответствующих солей. У менее активных металлов, например, меди или серебра, реакция с щелочью протекает медленнее.
Для удобства классификации металлов по их реакционной способности используется электрохимический ряд металлов. Чем выше металл в ряду, тем более активными являются его реакции с щелочами.
| Металл | Реакция с щелочью |
|---|---|
| Натрий | Активно реагирует, образуется щелочь и выделяется водород |
| Калий | Активно реагирует, образуется щелочь и выделяется водород |
| Медь | Реакция протекает медленнее, выделяется меньше водорода |
| Серебро | Реакция протекает медленнее, выделяется меньше водорода |
Таким образом, щелочные реакции металлов позволяют наблюдать и изучать их электрохимические свойства и отличия в их реакционной способности.
Таблица химических свойств металлов в 8 классе химии
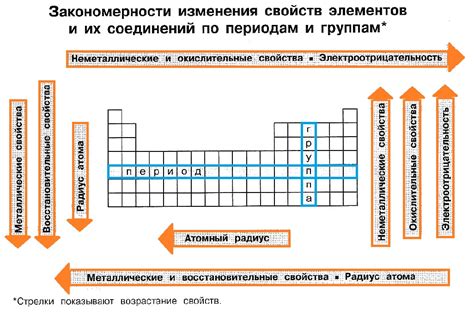
Восьмой класс химии является важным этапом изучения основных свойств металлов. Одним из основных инструментов, который используется при изучении этой темы, является таблица химических свойств металлов.
Таблица химических свойств металлов представляет информацию о различных химических свойствах металлов, таких как их активность, реактивность, способность образовывать ионы и соединения. Она помогает ученикам лучше понять и категоризировать металлы в соответствии с их химическими свойствами.
В таблице химических свойств металлов металлы обычно разделены на несколько групп в зависимости от их химических свойств. Например, активные металлы, такие как натрий и калий, обычно располагаются в первой группе, так как они обладают высокой реактивностью и способностью образовывать ионы с положительным зарядом.
Также таблица химических свойств металлов может содержать информацию о различных реакциях металлов с другими веществами, например, с кислотами или щелочами. Это помогает ученикам понять, какие металлы могут использоваться в различных химических реакциях и процессах.
Вопрос-ответ

Какие металлы считаются активными?
К активным металлам относятся металлы, способные реагировать с кислородом, водой и кислотами, такие как натрий, калий, кальций и магний.
Что происходит, когда металлы взаимодействуют с кислородом?
При взаимодействии металлов с кислородом образуется оксид металла. Например, железо при нагревании воздухе окисляется и образует ржавчину — оксид железа (III).
Какие металлы не реагируют с водой?
Некоторые металлы, такие как золото, платина и серебро, не реагируют с водой, поэтому они называются неподвижными или инертными металлами.
