Металлы – это группа химических элементов, которые обладают рядом уникальных свойств. Они обладают высокой теплопроводностью и электропроводностью, имеют блестящую поверхность и высокую плотность. Кроме того, металлы легко образуют сплавы с другими элементами и обладают способностью вступать в химические реакции.
Металлы обычно реагируют с кислородом, образуя оксиды. Например, железо взаимодействует с кислородом из воздуха, что приводит к образованию ржавчины. Алюминий реагирует с кислородом, образуя пленку оксида, которая защищает металл от дальнейшего окисления.
Металлы также могут реагировать с кислотами, образуя соли и выделяя водород. Например, реакция металла цинка с серной кислотой приводит к образованию соли цинка и выделению водорода:
Zn + H2SO4 → ZnSO4 + H2
Еще одной типичной реакцией металлов является реакция с водой. Некоторые металлы, такие как натрий и калий, реагируют с водой, образуя основания и выделяя водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода:
2Na + 2H2O → 2NaOH + H2
Таким образом, схема химических свойств металлов включает их реакции с кислородом, кислотами и водой. Эти реакции помогают определить химическую активность металлов и их способность вступать в химические превращения.
Исследование химических свойств металлов

Металлы – это группа химических элементов, обладающих определенными физическими и химическими свойствами. Изучение их химических свойств является важной задачей для понимания их поведения в различных реакциях и процессах.
Одним из способов исследования химических свойств металлов является проведение реакций с другими веществами. В ходе таких реакций может происходить образование соединений металла с различными элементами или группами атомов. Например, реакция металла с кислородом может привести к образованию оксида металла.
Другой важной химической реакцией, характерной для металлов, является реакция с кислотами. В результате такой реакции образуются соли металлов и выделяется водород. Некоторые металлы, такие как натрий или калий, реагируют с водой и выделяются соответствующие оксиды и водород.
Кроме того, исследование химических свойств металлов включает определение их способности к окислению и восстановлению. Некоторые металлы, например, алюминий или железо, способны вступать в реакции с кислородом и образовывать оксиды, что свидетельствует о их окислительных свойствах.
Важной частью исследования является также определение степени активности металлов. Это позволяет установить их способность реагировать с другими веществами и указывает на их реакционную способность.
В целом, изучение химических свойств металлов необходимо для понимания их химической активности, процессов окисления и восстановления, а также для рассмотрения их применений в различных областях науки и техники.
Особенности реакций металлов

Металлы характеризуются особыми свойствами и проявляют активность в различных химических реакциях. Одним из основных свойств металлов является их способность образовывать ионы положительного заряда (катионы) за счет отдачи электронов. Это свойство отражается в реакциях металлов с различными неорганическими и органическими соединениями.
Реакции металлов с кислотами являются одним из наиболее характерных проявлений их активности. Многие металлы, такие как натрий, железо, алюминий и цинк, активно реагируют с различными кислотами, образуя соли и выделяя водород. Например, реакция цинка с соляной кислотой протекает по следующему уравнению: Zn + 2HCl = ZnCl2 + H2.
Еще одной характерной реакцией, связанной с металлами, является реакция металла с водой. Однако не все металлы активно взаимодействуют с водой. Например, щелочные металлы, такие как натрий и калий, активно реагируют с водой, образуя гидроксиды и выделяя водород, а некоторые металлы, как серебро и золото, практически не реагируют с водой.
Окислительно-восстановительные реакции также являются важными для металлов. Металлы могут проявлять свою активность и как окислители, и как восстановители. Например, железо в реакции с кислородом окисляется из двухвалентного состояния до трехвалентного: 4Fe + 3O2 = 2Fe2O3.
Реакционная способность металлов

Реакционная способность металлов характеризует их способность взаимодействовать с другими веществами и проявляется в различных химических реакциях. Данная способность зависит от электрохимического потенциала металла, его электроотрицательности и ряда других факторов.
Металлы обладают высокой реакционной способностью, поэтому они часто вступают в химические реакции с кислотами, основаниями, солями, водой и другими веществами. Одной из наиболее известных реакций металлов является реакция с кислородом воздуха, иначе называемая окислением металла.
Реакция металлов с кислородом проходит с выделением тепла и образованием оксидов металлов. Например, железо взаимодействует с кислородом и образует оксид железа (III):
4Fe + 3O2 → 2Fe2O3
Кроме реакций металлов с кислородом, существует множество других реакций, в которых металлы могут выступать в качестве восстановителей или окислителей. Например, реакция цинка с серной кислотой протекает с образованием сульфата цинка и выделением газа сероводорода:
Zn + H2SO4 → ZnSO4 + H2S
Однако, реакционная способность металлов может быть различной и зависит от их положения в электрохимическом ряду. Некоторые металлы, такие как литий и калий, обладают высокой реакционной способностью и могут реагировать с водой с образованием гидроксидов и выделением водорода:
2Li + 2H2O → 2LiOH + H22K + 2H2O → 2KOH + H2
Металлы также могут реагировать с некоторыми солями, образуя осадки. Например, реакция алюминия с раствором соли меди(II) приводит к образованию осадка из меди и раствора соли алюминия:
2Al + 3CuSO4 → 3Cu + Al2(SO4)3
Таким образом, реакционная способность металлов является фундаментальным свойством, определяющим их взаимодействия с другими веществами и позволяющим использовать их в различных областях науки и техники.
Физические и химические свойства металлов

Физические свойства металлов:
Металлы обладают высокой тепло- и электропроводностью, что делает их важными для применения в электротехнике и электронике. Они также обладают высокой плотностью и являются прочными материалами, что позволяет использовать их для создания конструкций и механических устройств.
У металлов также высокая плавкость и точка кипения, что позволяет использовать их в процессе плавки и литья для создания различных металлических изделий. Они имеют блестящую поверхность и способны отражать свет, что придает им металлический блеск.
Химические свойства металлов:
Металлы обладают активностью в химических реакциях и легко вступают во взаимодействие с другими элементами. Они способны образовывать ионы путем отдачи электронов, что позволяет им образовывать ионные соединения.
Металлы могут реагировать с кислородом и образовывать оксиды, а также с водой, образуя гидроксиды. Они также способны вступать в реакции с кислотами, образуя соли.
Металлы играют важную роль в органической химии, так как являются катализаторами в различных химических реакциях. Они также могут образовывать комплексные соединения с органическими молекулами и служить важными компонентами в различных биологических системах.
Примеры реакций металлов
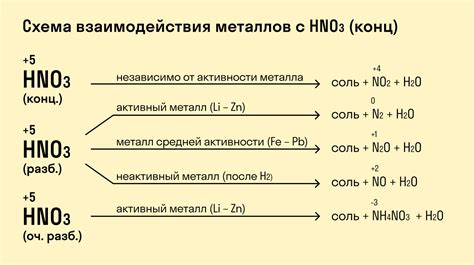
1. Реакция активных металлов с водой:
Активные металлы, такие как натрий, калий и литий, реагируют с водой, при этом образуется гидроксид металла и выделяется водород. Например, реакция натрия с водой:
2Na + 2H2O → 2NaOH + H2↑
2. Реакция металлов с кислотами:
Некоторые металлы, такие как цинк и алюминий, реагируют с кислотами, при этом образуется соль и выделяется водород. Например, реакция цинка с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2↑
3. Реакция металлов с кислородом:
Большинство металлов реагируют с кислородом из воздуха и образуют оксиды металлов. Например, реакция железа с кислородом:
4Fe + 3O2 → 2Fe2O3
4. Реакция металлов со солями:
Некоторые металлы, такие как железо и медь, реагируют с солями, образуя металлические соли и выделяя газ. Например, реакция железа с серной кислотой:
Fe + H2SO4 → FeSO4 + H2↑
5. Реакция металлов с щелочами:
Некоторые металлы, такие как алюминий и натрий, реагируют с щелочами, образуя гидроксиды металлов и выделяя водород. Например, реакция натрия с гидроксидом натрия:
2Na + 2NaOH → 2Na2O + H2↑
6. Реакция металлов с хлоридами:
Некоторые металлы, такие как цинк и алюминий, реагируют с хлоридами, образуя металлические хлориды и выделяя газ. Например, реакция цинка с хлоридом кальция:
Zn + CaCl2 → ZnCl2 + Ca↑
7. Реакция металлов с оксидами:
Некоторые металлы, такие как медь и железо, реагируют с оксидами, образуя металлические оксиды и выделяя энергию в виде тепла. Например, реакция меди с оксидом свинца:
2Cu + PbO → 2CuO + Pb
Это лишь некоторые примеры реакций металлов, которые демонстрируют их разнообразие и химические свойства.
Важность изучения химических свойств металлов

Изучение химических свойств металлов является важной задачей в области химии и материаловедения.
Металлы обладают уникальными химическими свойствами, которые определяют их возможности и применение в различных областях жизни. Они способны образовывать сплавы, реагировать с кислотами и щелочами, окисляться или восстанавливаться. Благодаря этим свойствам они находят применение в строительстве, медицине, электротехнике, авиации и многих других отраслях промышленности.
Изучение химических свойств металлов позволяет установить их реакционную способность, которая может играть важную роль в процессе преобразования и использования материалов на основе металлов. Также изучение свойств металлов позволяет оценить их стойкость к различным агрессивным средам и предсказать их поведение при воздействии различных факторов окружающей среды.
Изучение химических свойств металлов также позволяет разрабатывать новые материалы с улучшенными свойствами, такими как прочность, стойкость к коррозии, теплопроводность и электропроводность. Это особенно важно в современной технологии, где требуется создание новых материалов с определенными свойствами для различных целей.
Таким образом, изучение химических свойств металлов имеет огромное значение для развития научных исследований, инноваций и производства материалов с оптимальными характеристиками, что содействует развитию технологий и улучшению качества жизни людей.
Вопрос-ответ

Какие свойства металлов связаны с их химической активностью?
Самыми основными свойствами металлов, связанными с их химической активностью, являются атомарный радиус, ионный радиус, электроотрицательность, электронная конфигурация и заряд ядра. Эти свойства определяют способность металлов вступать в химические реакции и образовывать соединения с другими элементами. Кроме того, металлы также обладают свойством проявлять металлический блеск, быть проводниками электричества и тепла, иметь высокую пластичность и твердость.
Какие реакции металлов с кислотами могут происходить?
Металлы могут вступать в реакции с различными кислотами, образуя соли и выделяя водород. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водородный газ: Zn + 2HCl = ZnCl₂ + H₂. Некоторые металлы, такие как железо и алюминий, не реагируют с обычными растворами минеральных кислот, но могут реагировать с сильными окислителями, например, концентрированной серной кислотой.
Какие реакции металлов с кислородом могут происходить?
Металлы могут реагировать с кислородом, образуя оксиды. Например, при нагревании железа на воздухе происходит реакция с кислородом, и образуется черная корка, состоящая из оксида железа (III): 4Fe + 3O₂ = 2Fe₂O₃. Некоторые металлы, такие как алюминий и магний, реагируют с кислородом очень быстро и при комнатной температуре.
Какие реакции металлов с водой могут происходить?
Некоторые металлы могут реагировать с водой, образуя основания и выделяя водородный газ. Например, литий реагирует с водой с образованием гидроксида лития и выделением водорода: 2Li + 2H₂O = 2LiOH + H₂. Однако не все металлы реагируют с водой. Например, железо не реагирует с обычной водой, но может реагировать с паром воды при повышенных температурах или с кислородом в присутствии воды, образуя гидроксид железа.
